







17 марта 2015 года
Если ты хочешь повысить мощность четырехтактного двигателя внутреннего сгорания, существует несколько вариантов достижения этой цели. Первое — увеличить объем цилиндров. Второе — повысить количество сжигаемой в двигателе смеси посредством нагнетателя. Но если ты жаждешь действительно чего-то запредельного, то самый верный способ добиться своего — заменить топливную систему с бензиновой на более производительную.
Для начала — краткий научный экскурс, без которого статья не имеет смысла. Нитрометан — простейшее химическое соединение, в тех или иных формах имеющее широкое применение в различных областях: от изготовления композитных материалов до медицины. Но нас нитрометан интересует исключительно в качестве горючего для дрэгстеров. Основное отличие нитрометана от любого другого углеводородного топлива, требующего для горения забор кислорода извне, в том, что нитрометан (Ch4NO2) уже насыщен кислородом.
Огромное преимущество нитрометана в том, что он дает гораздо больше мощности с каждым взрывом в двигателе. В равных объемных долях взрыв нитрометана выделяет меньше энергии, чем взрыв бензина, но при одном и том же объеме цилиндра за единицу времени нитрометана сгорит гораздо больше. Как результат — ощутимый прирост мощности за каждый такт. В среднем потребуется 15,1 кг воздуха, чтобы сжечь 1 кг бензина, в то время как понадобится лишь 1,71 кг воздуха, чтобы расправиться с килограммом нитрометана. Это означает, что дьявольского топлива можно закачать в цилиндр практически в 9 раз больше бензина в единицу времени, при этом обеспечив полное сгорание смеси.
Нитрометан не так хорош как бензин в плане количества выделяемой энергии. Ты не получишь девятикратное увеличение мощности. Прирост мощности обычно составляет порядка 250%, что более чем внушительно, согласись. Нитрометан при сгорании вырабатывает больше энергии, чем динамит, несмотря на то, что обладает более низкой скоростью детонации. Кто и каким образом додумался лить взрывчатку в цилиндры, мы разберемся ниже.
Первыми к использованию этого топлива пришли немцы в 30-х годах во времена рассвета Третьего Рейха. Существует легенда, что нитрометан изначально применяли для промывки деталей двигателя и как-то раз, запустив мотор с незначительными остатками будущего адского топлива, обнаружили ощутимый прирост мощности. Лично я сильно сомневаюсь в правдоподобности данного мифа и считаю, что нитрометан в автоспорте появился благодаря целенаправленной работе немецких ученых.
Во второй половине 30-х годов, Германия переживала небывалый подъем национального самосознания, которое нацистскому правительству было позарез нужно поддерживать на должном уровне. Поэтому немцы просто обязаны были быть первыми во всех областях жизни общества, включая автоспорт.
Mercedes-Benz и Auto Union были на пике славы и побеждали в Гран-при Европы, практически не зная конкуренции. Денег на гоночные технологии не жалели, и уже в те времена многолитровые наддувные моторы «Серебряных стрел» позволяли развивать скорость свыше 400 км/ч. И началась битва за рекорды. Первое задокументированное упоминание об использовании нитрометана в качестве топлива отсылает нас к болидам, специально спроектированным Фердинандом Порше для установки рекордной скорости на земле. Стремительные обтекаемые гоночные автомобили с открытыми колесами опережали доступные технологии своего времени на десятилетия, однако поражение Германии во Второй Мировой войне похоронило большинство достижений под обломками рухнувшего Рейха.
Последняя довоенная версия Rekordwagen от Auto Union имела кузов с закрытыми арками и оснащалась 6,5-литровым V12 с двумя нагнетателями Roots, который выдавал внушительные по тем временам 560 л.с. По разным версиям в сложном многокомпонентном топливе содержалось до 85% нитрометана. Попытка рекорда закончилась трагедией: на скорости 431 км/ч пилот Бернд Розмайер (Bernd Rosemeyer) не справился с управлением и вылетел за пределы дорожного полотна автобана. Уровень безопасности автомобилей первой половины XX века не оставил ему ни одного шанса на выживание в этой жуткой катастрофе. Однако рекорд скорости для дорог общего пользования до сих пор принадлежит Германии: в 1938 году Рудольф Караччиола (Rudolf Caracciola) развил на своем Mercedes-Benz фантастические 432,7 км/ч. Во многом благодаря адскому топливу.
Историки сходятся на том, что впервые нитрометан применил в гонках на территории США Вик Эдельброк старший (Vic Edelbrock Sr), а дело успешно продолжил его сын Вик Эдельброк младший. Началось все с того, что в их мастерскую в 49 году пришел приятель Эд Хэддет (Ad Haddat) и отдал за ненадобностью один галлон топлива содержащего нитрометан со словами «Мне определенно это ни к чему, потому что оно может взорваться прямо в руках». Эдельброка это не остановило. Со своими коллегами в лице Бобби Микса (Bobby Meeks) и Фрэна Эрнандеса (Fran Hernandes) он сразу же решился на первый эксперимент. Первый запуск на диностенде 136ci V8–60 Midget объемом 2,2 литра питающегося смесью метанола и нитрометана в соотношении 9/1 позволил снять с двигателя впечатляющие 200 л. с. Однако, первые проблемы не заставили себя долго ждать: перешедший на калильное зажигание двигатель было невозможно заглушить, пришлось накрыть мотор влажным полотенцем, дабы его остудить и перекрыть доступ кислорода.
После многочисленных тестов Вик пришел к оптимальному соотношению метанола и нитрометана — 8/2, что давало прибавку в 40 л. с. без критичных последствия для ресурса силовой установки. Позже в 1949 на первом легальном соревновании по дрэг-рейсингу на аэродроме в Голета Фрэн Эрнандес на подготовленном в мастерской Эдельброка Ford ’32 с внушительным отрывом побеждает Тома Коббса (Tom Cobbs), пилотирующего свой оснащенный наддувным двигателем Roadster. Однако известным на всю Америку Эдельброка сделала не эта победа, а кольцевые гонки на знаменитом Gilmore Stadium, в которых Роджер Уорд (Roger Ward) в 1950 году не оставил ни единого шанса конкурентам, использующим доминировавший тогда в своем классе четырехцилиндровый двигатель Offenhauser. На следующий день Уорд закрепил свой успех на гонке в Сан-Бернардино.
Несмотря на то, что рецептура топлива держалась в строжайшем секрете, языки пламени, вырывающиеся из выхлопных патрубков, многих наводили на мысли о том, что секрет победы кроется в том, что горит в цилиндрах болидов Эдельброка. Так или иначе, в начале 50-х многие гонщики вовсю экспериментировали с горючим, и нитрометан обрел популярность на дрэг-стрипах, соляных озерах и даже в серии Indy 500, где был разрешен до 1954 года. В 1952 году в Бонневилле Flathead V8, питающийся 40-процентной смесью нитрометана, позволил превысить отметку в 200 миль в час, однако заклинивший выпускной клапан не позволил подтвердить рекорд во второй попытке.
1 апреля 1957 года NHRA накладывает запрет на использование «ракетного топлива» на всех мероприятиях ассоциации, который продержался без малого семь лет. Естественно, на протяжении этого периода, инженеры не сидели без дела, потому что титанический прирост мощности от использования нитрометана был очевиден для всех. Гонщикам нужны были новые рекорды, а зрителям былые скорости, и, в конце концов, 1964 год ознаменовал снятие запрета.
Чистый нитрометан в качестве топлива на данный момент разрешен только в классе Top Fuel водного дрэг-чемпионата Lucas Oil Drag Boat Racing Series. Большинство механиков и инженеров автомобильного мира сходятся на мысли, что использование стопроцентного нитрометана предельно губительно сказывается на ресурсе агрегатов двигателя, а также отрицательно влияет на стабильность работы мотора в целом. Т.е. шансы того, что силовая установка проживет хотя бы один заезд, существенно снижаются, нежели в условиях использования нитрометана в смеси с другими видами горючего.
Оптимальные пропорции были предложены гениальным механиком и инженером Джином Адамсом (Gene Adams). По его мнению, нужно лить в цилиндры 98% нитрометана в смеси с метанолом, чтобы обеспечить наибольшую мощность, сохранив при этом ресурс двигателя на должном уровне. Несмотря на то, что современные системы впрыска топлива и зажигания позволяют подготовленным моторам без проблем пережить один заезд на такой смеси, на сегодняшний день регламент NHRA разрешает применять в Top Fuel и Funny Car топливо, состоящие максимум на 90% из нитрометана. Безусловно, из соображений безопасности.
www.dragtimes.ru
Бурная история нитрометана начинается в 30-х годах двадцатого века, когда немецкие механики обнаружили, что оставшиеся внутри двигателя остатки очистителя, называемого нитрометан, способствовали улучшению сгорания топлива и увеличению мощности мотора. Позднее, в 50-ых годах прошлого века, американские солдаты увезли секрет «нитро» к себе на родину и использовали нитрометан как присадку к топливу. Он стал «механическим компрессором для бедного человека».Основной способ добавить двигателю мощности — закачать в камеру сгорания дополнительный объем кислорода путем установки на мотор механического компрессора для турбонаддува.
 Роль нитрометана в моторах гоночных машин — химический «турбонаддув». В нитрогруппе этого соединения присутствует кислород (О2), который выходит из химической связи с азотом и вступает в реакцию окисления (горения). Азот (N2) слабое в химическом отношении вещество — он может быть окислителем для водорода (аммиак Nh4), но кислородом окисляется сам, т.е. химическую связь не держит, и при повышении температуры сдает позиции и уходит из молекулы нитрогруппы в атмосферу, при этом освобождая атомы кислорода. Именно этот кислород из нитрометана совместно с кислородом воздуха участвует в горении углерода топлива.
Роль нитрометана в моторах гоночных машин — химический «турбонаддув». В нитрогруппе этого соединения присутствует кислород (О2), который выходит из химической связи с азотом и вступает в реакцию окисления (горения). Азот (N2) слабое в химическом отношении вещество — он может быть окислителем для водорода (аммиак Nh4), но кислородом окисляется сам, т.е. химическую связь не держит, и при повышении температуры сдает позиции и уходит из молекулы нитрогруппы в атмосферу, при этом освобождая атомы кислорода. Именно этот кислород из нитрометана совместно с кислородом воздуха участвует в горении углерода топлива.
Результат — больший объем кислорода сжигает больший объем топлива за один рабочий ход поршня. Больше топлива за один взрыв в камере сгорания — сильнее удар по поршню, соответственно, увеличивается мощность двигателя. Для сравнения: в чистом виде, если в одной и той же камере сгорания может сгореть 1 «кубик» метилового спирта, то с использованием нитрометана сгорит 2,5 «кубика» за тоже время. И все же, почему в моторах большого объема для получения большей мощности выгоднее использовать не бензин, а нитрометан?
 Содержание кислорода в нитрометане позволяет ему гореть с много меньшим количеством атмосферного воздуха по сравнению с углеводородами бензина:
Содержание кислорода в нитрометане позволяет ему гореть с много меньшим количеством атмосферного воздуха по сравнению с углеводородами бензина:
4Ch4NO2 + 3O2 → 4CO2 + 6h3O + 2N2
Примерно 14,7 кг воздуха необходимо для сжигания килограмма бензина, но только 1,7 кг воздуха приходится на сжигание на один килограмм нитрометана. Так как цилиндр двигателя может содержать только ограниченное количество воздуха при каждом такте, в 8,7 раз больше нитрометана по сравнению с бензином может быть сожжено в один такт. Нитрометан,однако, имеет меньшую плотность энергии: бензин выделяет около 42–44 МДж/кг в то время как, нитрометан даёт 11,3 МДж/кг. Этот расчёт показывает, что нитрометан производит примерно в 2,3 раза больше мощности по сравнению с обычным топливом.
Нитрометан также может быть использован как монопропеллант, т. е. топливо, способное гореть без добавки кислорода, ниже уравнение этой реакции:
4Ch4NO2 → 4CO + 4h3O + 2h3 + 2N2
Нитрометан имеет ламинарную скорость горения 0,5 м/с (немного выше чем у бензина), таким образом делая его пригодным для высокоскоростных двигателей. Кроме того, температура пламени несколько выше — 2400 °C. Высокая удельная теплота парообразования (0,56 МДж/кг) вместе с высокой скоростью течения приводит к сильному охлаждению подходящего топлива (примерно вдвое больше, чем у метанола), в результате получаются довольно низкие температуры.
Нитрометан часто используют в богатых воздушно-топливных смесях, поскольку он даёт энергию даже при отсутствии атмосферного кислорода. При использовании богатой воздушно-топливной смеси, часть продуктов сгорания — водород и монооксид углерода. Эти газы часто воспламеняются, иногда впечатляюще, когда очень богатые смеси ещё горящего топлива покидают выхлопные трубы. Очень богатые смеси необходимы, чтобы снизить температуру камеры сгорания, для управления предварительным зажиганием и последующей детонацией. Рабочие детали зависят от свойства смеси и характеристики двигателя.
nitrometan.ru
 Нитрометан. Каждый знает, что он существует, но немногие, по-видимому, действительно знают о нем все. Несмотря на то, что многие знают (по крайней мере, предположительно), что его основное назначение - это добавить мощности, мы все еще получаем время от времени звонки и письма с вопросом, "Почему мы используем его в модельном топливе?". В лучшем случае есть много дезинформации относительно этого несколько экзотического компонента. Рассмотрим информацию, которая поможет прояснить суть нитрометана. Да, НИТРОМЕТАН = МОЩНОСТЬ! Но...есть условия и непредвиденные обстоятельства. Прежде всего, он не добавляет мощность как таковую, потому что он не такой "теплотворный", как метанол. Это может быть сюрпризом для большинства читателей, но метанол (метиловый спирт) в топливе - намного более легко воспламеняемый компонент. Он воспламеняется примерно вдвое лучше, чем нитрометан. Фактически, если бы у нитрометана температура воспламенения была только на 4 градуса выше, то он даже не должен был бы нести красную метку "огнеопасно"! Нитрометан горит желтым пламенем. Наблюдаемое ночью белое свечение это догорание водорода выделяемого из влаги содержащийся в атмосфере под воздействием температуры выхлопных газов.
Нитрометан. Каждый знает, что он существует, но немногие, по-видимому, действительно знают о нем все. Несмотря на то, что многие знают (по крайней мере, предположительно), что его основное назначение - это добавить мощности, мы все еще получаем время от времени звонки и письма с вопросом, "Почему мы используем его в модельном топливе?". В лучшем случае есть много дезинформации относительно этого несколько экзотического компонента. Рассмотрим информацию, которая поможет прояснить суть нитрометана. Да, НИТРОМЕТАН = МОЩНОСТЬ! Но...есть условия и непредвиденные обстоятельства. Прежде всего, он не добавляет мощность как таковую, потому что он не такой "теплотворный", как метанол. Это может быть сюрпризом для большинства читателей, но метанол (метиловый спирт) в топливе - намного более легко воспламеняемый компонент. Он воспламеняется примерно вдвое лучше, чем нитрометан. Фактически, если бы у нитрометана температура воспламенения была только на 4 градуса выше, то он даже не должен был бы нести красную метку "огнеопасно"! Нитрометан горит желтым пламенем. Наблюдаемое ночью белое свечение это догорание водорода выделяемого из влаги содержащийся в атмосфере под воздействием температуры выхлопных газов. Двигатель внутреннего сгорания достаточно легко поддается тюнингу, однако лишь до определенного предела. Больше некой величины мощность двигателя поднять нельзя. Конечно, эта величина различна для разных двигателей, но все же она существует. Существует мнение, что преодолеть этот порог невозможно. Но выход все же есть. И искать его следует в драг-рейсинге. Зачастую автомобили, участвующие в гонках на ускорение, заправлены совсем не бензином…
Двигатель внутреннего сгорания достаточно легко поддается тюнингу, однако лишь до определенного предела. Больше некой величины мощность двигателя поднять нельзя. Конечно, эта величина различна для разных двигателей, но все же она существует. Существует мнение, что преодолеть этот порог невозможно. Но выход все же есть. И искать его следует в драг-рейсинге. Зачастую автомобили, участвующие в гонках на ускорение, заправлены совсем не бензином…  Смена топлива – достаточно решительный шаг, требующий серьезного вмешательства в структуру двигателя. Кроме того, такое изменение реально произвести только на инжекторном двигателе. Конечно, можно переделать двигатель под любое горючее, но наиболее распространенными являются производные азота - диоксид азота (NO2) и нитрометан. Между ними есть достаточно большое различие. Рассмотрим каждый из них в отдельности.
Смена топлива – достаточно решительный шаг, требующий серьезного вмешательства в структуру двигателя. Кроме того, такое изменение реально произвести только на инжекторном двигателе. Конечно, можно переделать двигатель под любое горючее, но наиболее распространенными являются производные азота - диоксид азота (NO2) и нитрометан. Между ними есть достаточно большое различие. Рассмотрим каждый из них в отдельности.  Диоксид азота, столь любимый уличными гонщиками, является более «мягким» топливом. Скорость и мощность детонации этого топлива примерно в 2-3 раза выше, чем у бензина, что, соответственно, означает соответствующее повышение мощности. Однако и удельная теплоотдача при сгорании также намного выше, так что использование этого топлива сильно повышает рабочую температуру двигателя. Также неприятный побочный эффект применения диоксида азота – пламя, постоянно прорывающееся за выпускные клапана и зачастую даже за пределы выхлопной трубы. Для перехода на другой вид топлива необходима серьезная переработка двигателя. Так, если говорить о диоксиде азота, то существуют два варианта топливной системы, предназначенной для его применения – постоянная и частичная. Постоянная система, как следует из названия, полностью заменяет бензиновую систему впуска. Для ее установки необходимо: поменять топливный бак, так как бак, предназначенный для бензина, может попросту не выдержать другого топлива; сменить форсунки впрыска, а также желательно, но не обязательно, заменить цилиндро-поршневую группу и выхлопную систему на более прочные, так как в противном случае они прослужат недолго. Также нелишним будет усовершенствовать систему охлаждения.
Диоксид азота, столь любимый уличными гонщиками, является более «мягким» топливом. Скорость и мощность детонации этого топлива примерно в 2-3 раза выше, чем у бензина, что, соответственно, означает соответствующее повышение мощности. Однако и удельная теплоотдача при сгорании также намного выше, так что использование этого топлива сильно повышает рабочую температуру двигателя. Также неприятный побочный эффект применения диоксида азота – пламя, постоянно прорывающееся за выпускные клапана и зачастую даже за пределы выхлопной трубы. Для перехода на другой вид топлива необходима серьезная переработка двигателя. Так, если говорить о диоксиде азота, то существуют два варианта топливной системы, предназначенной для его применения – постоянная и частичная. Постоянная система, как следует из названия, полностью заменяет бензиновую систему впуска. Для ее установки необходимо: поменять топливный бак, так как бак, предназначенный для бензина, может попросту не выдержать другого топлива; сменить форсунки впрыска, а также желательно, но не обязательно, заменить цилиндро-поршневую группу и выхлопную систему на более прочные, так как в противном случае они прослужат недолго. Также нелишним будет усовершенствовать систему охлаждения.  Частичная система не требует серьезных изменений. Она предназначена для кратковременного впрыска небольших порций смеси бензина с диоксидом азота в цилиндры. Для ее применения потребуется лишь установить дополнительный бак и провести дополнительный топливопровод. Фильтры не требуются, так как сжиженный диоксид азота является прекрасным растворителем, а в газообразном наличие примесей в в идее твердых частиц весьма сомнительно. Каковы итоги? Двигатель, использующий диоксид азота в качестве топлива, имеет достаточно низкую ресурсную прочность – в 2-4 раза ниже обычного, работающего на бензине. Мощность же поднимается в 3-5 раз. Максимальная мощность при тюнинге может достигать 1500-2000 лошадиных сил. Как уже было сказано, оксид азота является достаточно мягким топливом, но все же при его применении стоит снизить периодичность технического обслуживания до 1 раза в 1000 – 1500 километров пробега. Максимальный пробег двигателя обычно не превышает 200000 – 250000 километров.
Частичная система не требует серьезных изменений. Она предназначена для кратковременного впрыска небольших порций смеси бензина с диоксидом азота в цилиндры. Для ее применения потребуется лишь установить дополнительный бак и провести дополнительный топливопровод. Фильтры не требуются, так как сжиженный диоксид азота является прекрасным растворителем, а в газообразном наличие примесей в в идее твердых частиц весьма сомнительно. Каковы итоги? Двигатель, использующий диоксид азота в качестве топлива, имеет достаточно низкую ресурсную прочность – в 2-4 раза ниже обычного, работающего на бензине. Мощность же поднимается в 3-5 раз. Максимальная мощность при тюнинге может достигать 1500-2000 лошадиных сил. Как уже было сказано, оксид азота является достаточно мягким топливом, но все же при его применении стоит снизить периодичность технического обслуживания до 1 раза в 1000 – 1500 километров пробега. Максимальный пробег двигателя обычно не превышает 200000 – 250000 километров.  Нитрометан – более бескомпромиссный вариант. При его сгорании выделяется огромное количество тепла, что влияет не только на увеличение мощности, но и на увеличение температуры двигателя и ускорение износа. Также нитрометан довольно-таки взрывоопасен. Нитрометановые системы бывают лишь постоянные, так как смесь нитрометана с бензином является очень неустойчивой и взрывоопасной. Для применения нитрометана желательно поменять двигатель вообще. Зачастую для него используются двигатели с чугунными блоками цилиндров, так как они являются более прочными. И все равно, нитрометан буквально сжигает двигатель за 5000-10000 километров пробега. Поэтому его целесообразно применять только для автоспорта. Но результаты превосходят все ожидания – мощность увеличивается в 10-15 раз. Предел форсировки точно не определен, но он составляет около 9000-10000 лошадиных сил.
Нитрометан – более бескомпромиссный вариант. При его сгорании выделяется огромное количество тепла, что влияет не только на увеличение мощности, но и на увеличение температуры двигателя и ускорение износа. Также нитрометан довольно-таки взрывоопасен. Нитрометановые системы бывают лишь постоянные, так как смесь нитрометана с бензином является очень неустойчивой и взрывоопасной. Для применения нитрометана желательно поменять двигатель вообще. Зачастую для него используются двигатели с чугунными блоками цилиндров, так как они являются более прочными. И все равно, нитрометан буквально сжигает двигатель за 5000-10000 километров пробега. Поэтому его целесообразно применять только для автоспорта. Но результаты превосходят все ожидания – мощность увеличивается в 10-15 раз. Предел форсировки точно не определен, но он составляет около 9000-10000 лошадиных сил.  При установке нитрометановой системы желательно доработать и кузов автомобиля и отделить выхлопную систему от кузова, так как температура выхлопных газов и пламени, образующегося при сгорании нитрометана чрезвычайно высока – до 1200 градусов. Понятно, что стоит провести те же доработки, что и в случае с диоксидом азота, но еще в большей мере и с большим запасом прочности. В действительности, нитрометан должен быть нагрет до 96 градусов F, для того, чтобы он начал испускать достаточно паров, которые могут быть зажжены какой-нибудь искрой или пламенем! (Я демонстрировал это недавно другу, неоднократно помещая горящую спичку в небольшую емкость, полную нитрометана. Я могу добавить, что он не приблизился на расстояние менее 20 футов в течение демонстрации.) Теперь о том, как же это все-таки добавляет мощность? Все мы знаем, что есть другое "топливо", без которого жидкая часть была бы бесполезна. Помните, что это? Правильно. Это - воздух (в действительности же - кислород в воздухе). Каждый двигатель внутреннего сгорания смешивает воздух и жидкое топливо некоторого вида. В нашем случае это жидкое калильное топливо. Цель карбюратора состоит в том, чтобы отмерить эти два компонента в нужной пропорции, и каждый двигатель требует определенной пропорции жидкого топлива и воздуха. Попробуйте добавить слишком много жидкости без достаточного количества воздуха, и двигатель не будет работать вообще. Какова цель турбонаддува на полноразмерных двигателях? Нагнетать немного больше воздуха, чем сможет обработать простой карбюратор или инжекторная топливная система.
При установке нитрометановой системы желательно доработать и кузов автомобиля и отделить выхлопную систему от кузова, так как температура выхлопных газов и пламени, образующегося при сгорании нитрометана чрезвычайно высока – до 1200 градусов. Понятно, что стоит провести те же доработки, что и в случае с диоксидом азота, но еще в большей мере и с большим запасом прочности. В действительности, нитрометан должен быть нагрет до 96 градусов F, для того, чтобы он начал испускать достаточно паров, которые могут быть зажжены какой-нибудь искрой или пламенем! (Я демонстрировал это недавно другу, неоднократно помещая горящую спичку в небольшую емкость, полную нитрометана. Я могу добавить, что он не приблизился на расстояние менее 20 футов в течение демонстрации.) Теперь о том, как же это все-таки добавляет мощность? Все мы знаем, что есть другое "топливо", без которого жидкая часть была бы бесполезна. Помните, что это? Правильно. Это - воздух (в действительности же - кислород в воздухе). Каждый двигатель внутреннего сгорания смешивает воздух и жидкое топливо некоторого вида. В нашем случае это жидкое калильное топливо. Цель карбюратора состоит в том, чтобы отмерить эти два компонента в нужной пропорции, и каждый двигатель требует определенной пропорции жидкого топлива и воздуха. Попробуйте добавить слишком много жидкости без достаточного количества воздуха, и двигатель не будет работать вообще. Какова цель турбонаддува на полноразмерных двигателях? Нагнетать немного больше воздуха, чем сможет обработать простой карбюратор или инжекторная топливная система.  Предположим, что мы должны были найти путь для сжигания большего количества жидкости в наших модельных двигателях без увеличения поступления воздуха. Это добавило бы мощности, не так ли? Хорошо, предположите, что мы это можем! Двигатель внутреннего сгорания может сжечь нитрометана более чем в 2 раза больше, чем метанола, используя один и тот же объем воздуха. Вот и все! Мы получили больше мощности. Вот так это работает, и это нетрудно для понимания. И мы не должны тратить много времени на размышление об этом в ходе повседневных полетов. Однако существуют некоторые факторы, которые мы должны рассмотреть. Практически все обычные полеты могут быть выполнены на модельном топливе, содержащем от 5% до 15% нитрометана. Если Вы летаете на чем-то вроде тренера, или Cub, или подобной модели, нет, вероятно, никакой причины, почему бы 5% топливу не работать отлично. Требуется немного больше мощности? Используйте 10% или 15% содержание нитрометана в топливе. Я не рекомендовал бы использовать топливо с более высоким содержанием нитрометана в большинстве популярных двигателей. Увеличение содержания нитрометана, вероятно, ничему не повредит, но ничего и не даст. Мы продаем больше топлива с 15% нитрометана, чем любых других топливных смесей, и для этого есть серьезная причина. Большинство популярных двигателей на рынке сегодня разработано для того, чтобы работать на такой смеси. Как правило, европейские двигатели успешно работают на смесях с более низким содержанием нитрометана, потому что они рассчитаны на это. Почему? В Европе нитрометан может стоить между 150$ и 200$ за галлон! Достаточное основание?
Предположим, что мы должны были найти путь для сжигания большего количества жидкости в наших модельных двигателях без увеличения поступления воздуха. Это добавило бы мощности, не так ли? Хорошо, предположите, что мы это можем! Двигатель внутреннего сгорания может сжечь нитрометана более чем в 2 раза больше, чем метанола, используя один и тот же объем воздуха. Вот и все! Мы получили больше мощности. Вот так это работает, и это нетрудно для понимания. И мы не должны тратить много времени на размышление об этом в ходе повседневных полетов. Однако существуют некоторые факторы, которые мы должны рассмотреть. Практически все обычные полеты могут быть выполнены на модельном топливе, содержащем от 5% до 15% нитрометана. Если Вы летаете на чем-то вроде тренера, или Cub, или подобной модели, нет, вероятно, никакой причины, почему бы 5% топливу не работать отлично. Требуется немного больше мощности? Используйте 10% или 15% содержание нитрометана в топливе. Я не рекомендовал бы использовать топливо с более высоким содержанием нитрометана в большинстве популярных двигателей. Увеличение содержания нитрометана, вероятно, ничему не повредит, но ничего и не даст. Мы продаем больше топлива с 15% нитрометана, чем любых других топливных смесей, и для этого есть серьезная причина. Большинство популярных двигателей на рынке сегодня разработано для того, чтобы работать на такой смеси. Как правило, европейские двигатели успешно работают на смесях с более низким содержанием нитрометана, потому что они рассчитаны на это. Почему? В Европе нитрометан может стоить между 150$ и 200$ за галлон! Достаточное основание?  Нитрометан дает больше, чем просто прибавка мощности. Он помогает достигать устойчивого холостого хода при более низких оборотах. Есть один хорошей тест для проверки, чтобы узнать, нуждается ли конкретный двигатель в большем содержании нитрометана в топливе. Заведите двигатель, дайте ему прогреться в течение нескольких секунд, установите газ на минимальные холостые обороты, и удалите накал свечи. Если при этом обороты двигателя уменьшаются, используйте смесь с более высоким содержанием нитрометана. Если нет заметного снижения оборотов, значит, смесь хорошо подходит к Вашему двигателю. Одно из наиболее популярных неправильных представлений - то, что, существенно повысив содержание нитрометана, пользователь немедленно получит огромный скачок мощности. Это не так. Вы будете сильно удивлены, узнав, что в диапазоне 5% - 25% содержания нитрометана, Вы, скорее всего, увидите увеличение оборотов приблизительно на 100 обмин в статике(на земле или на испытательном стенде) для каждого увеличения содержания нитрометана на 5%. В полете, при разгрузке винта, увеличение будет большим, и, вероятно, улучшится также холостой ход. Мое любимое правило: Если Вы имеете хорошо летающую модель, и ей только иногда немного недостает мощности, то увеличьте содержание нитрометана на 5%. Если модель не летает, как надо, Вы нуждаетесь в более мощном двигателе, а не в большем содержании нитрометана! Большинство популярных спортивных двигателей, использующихся сегодня, не рассчитано на работу на топливе, содержащем больше, чем 15%…20% нитрометана. Увеличение количества нитрометана в смеси имеет эффект увеличения степени сжатия, а каждый определенный двигатель имеет оптимальную степень сжатия. Превысите ее - и работа мотора, вероятно, станет хуже, а не лучше и двигатель будет гораздо менее "дружественным к пользователю". Высококлассные гоночные двигатели настраиваются совсем по-другому (степень сжатия, фазы газораспределения, согласованная выхлопная система и т.д.) и обычно рассчитываются так, чтобы использовать смеси с высоким содержанием нитрометана. За одним исключением - это гоночные двигатели, используемые на международных соревнованиях и мировом чемпионате (FAI). Правилами для этих двигателей не разрешают использовать нитрометан вообще, и они работают так же, как и те, что работают на топливе с содержанием нитрометана в 60% или 65%! Первый вопрос, который приходит на ум - "Почему не все двигатели разрабатывают таким образом, чтобы они могли работать без нитрометана, ведь тогда мы смогли бы сэкономить много денег? " Спросите любого из спортсменов мирового класса. Он скажет, что их двигатели очень сволочны при настройке и определенно не дружественны! Фактически, они - хороши, но требуют уровней навыка выше большинства средних летчиков. За все надо платить.
Нитрометан дает больше, чем просто прибавка мощности. Он помогает достигать устойчивого холостого хода при более низких оборотах. Есть один хорошей тест для проверки, чтобы узнать, нуждается ли конкретный двигатель в большем содержании нитрометана в топливе. Заведите двигатель, дайте ему прогреться в течение нескольких секунд, установите газ на минимальные холостые обороты, и удалите накал свечи. Если при этом обороты двигателя уменьшаются, используйте смесь с более высоким содержанием нитрометана. Если нет заметного снижения оборотов, значит, смесь хорошо подходит к Вашему двигателю. Одно из наиболее популярных неправильных представлений - то, что, существенно повысив содержание нитрометана, пользователь немедленно получит огромный скачок мощности. Это не так. Вы будете сильно удивлены, узнав, что в диапазоне 5% - 25% содержания нитрометана, Вы, скорее всего, увидите увеличение оборотов приблизительно на 100 обмин в статике(на земле или на испытательном стенде) для каждого увеличения содержания нитрометана на 5%. В полете, при разгрузке винта, увеличение будет большим, и, вероятно, улучшится также холостой ход. Мое любимое правило: Если Вы имеете хорошо летающую модель, и ей только иногда немного недостает мощности, то увеличьте содержание нитрометана на 5%. Если модель не летает, как надо, Вы нуждаетесь в более мощном двигателе, а не в большем содержании нитрометана! Большинство популярных спортивных двигателей, использующихся сегодня, не рассчитано на работу на топливе, содержащем больше, чем 15%…20% нитрометана. Увеличение количества нитрометана в смеси имеет эффект увеличения степени сжатия, а каждый определенный двигатель имеет оптимальную степень сжатия. Превысите ее - и работа мотора, вероятно, станет хуже, а не лучше и двигатель будет гораздо менее "дружественным к пользователю". Высококлассные гоночные двигатели настраиваются совсем по-другому (степень сжатия, фазы газораспределения, согласованная выхлопная система и т.д.) и обычно рассчитываются так, чтобы использовать смеси с высоким содержанием нитрометана. За одним исключением - это гоночные двигатели, используемые на международных соревнованиях и мировом чемпионате (FAI). Правилами для этих двигателей не разрешают использовать нитрометан вообще, и они работают так же, как и те, что работают на топливе с содержанием нитрометана в 60% или 65%! Первый вопрос, который приходит на ум - "Почему не все двигатели разрабатывают таким образом, чтобы они могли работать без нитрометана, ведь тогда мы смогли бы сэкономить много денег? " Спросите любого из спортсменов мирового класса. Он скажет, что их двигатели очень сволочны при настройке и определенно не дружественны! Фактически, они - хороши, но требуют уровней навыка выше большинства средних летчиков. За все надо платить.  Другое утверждение, которое мы часто читаем или слышим - это то, что нитрометан имеет кислотную реакцию и приводит к коррозии двигателя. На самом деле он не имеет кислотной реакции, и изготовители говорят, что коррозии не происходит, или, по крайней мере, не может произойти. Однако, один известный эксперт по двигателям и автор журнала упорно утверждает, что это происходит. Легкомысленный "штамп". (Я когда-то спросил Дейва Шадела, 3-кратного чемпиона мира, человека, который использует больше высококлассных двигателей, чем любой, кого я знаю: как часто он сталкивается с ржавчиной в двигателях, которые работают на смеси с высоким содержанием нитрометана? Его ответ был: " Никогда.") Почему нитрометан стоит так дорого? Я не имею никаких сведений относительно стоимости производства, но производство требует многомиллионных инвестиций в большой очистительный завод. Существует, однако, серьезная причина для высокой стоимости нитрометана: есть только один его изготовитель в Западном Полушарии. Примите это к сведению. Также (и это будет большой неожиданностью), наше хобби потребляет только приблизительно 5% всего произведенного нитрометана; полный объем потребления его автогонщиками и другими тоже около 5%. Это означает, что мы не имеем никакого влияния вообще, и просто должны платить запрашиваемую цену. Куда же идет остальная часть? Промышленность. Нитрометан используется для разнообразных составов - растворитель для некоторых пластмасс, производство инсектицидов, удобрений, взрывчатых веществ (да, это был компонент в бомбежке Оклахома-Сити) и это - компонент в Tagamet, известном составе для лечения язвы (неудивительно, что материал является настолько дорогим!). Пожалуйста, обратите внимание, что, в то время как нитрометан - компонент в создании некоторых взрывчатых веществ, сам по себе он не является взрывчатым веществом. (Помните - он используется в удобрениях.) Не проходит и месяца, чтобы кто-нибудь не позвонил, чтобы спросить: "Я слышал, что большее количество нитрометана будет снижать рабочую температуру моего двигателя. Это правда?" Нет. Чем выше содержание нитрометана, тем выше рабочая температура. К счастью, в большинстве наших двигателей различие в рабочей температуре между 5% и 10%-процентным топливом незначительно, и есть совокупность других факторов (надлежащее смазывание и т.д.), которые являются гораздо более важными.
Другое утверждение, которое мы часто читаем или слышим - это то, что нитрометан имеет кислотную реакцию и приводит к коррозии двигателя. На самом деле он не имеет кислотной реакции, и изготовители говорят, что коррозии не происходит, или, по крайней мере, не может произойти. Однако, один известный эксперт по двигателям и автор журнала упорно утверждает, что это происходит. Легкомысленный "штамп". (Я когда-то спросил Дейва Шадела, 3-кратного чемпиона мира, человека, который использует больше высококлассных двигателей, чем любой, кого я знаю: как часто он сталкивается с ржавчиной в двигателях, которые работают на смеси с высоким содержанием нитрометана? Его ответ был: " Никогда.") Почему нитрометан стоит так дорого? Я не имею никаких сведений относительно стоимости производства, но производство требует многомиллионных инвестиций в большой очистительный завод. Существует, однако, серьезная причина для высокой стоимости нитрометана: есть только один его изготовитель в Западном Полушарии. Примите это к сведению. Также (и это будет большой неожиданностью), наше хобби потребляет только приблизительно 5% всего произведенного нитрометана; полный объем потребления его автогонщиками и другими тоже около 5%. Это означает, что мы не имеем никакого влияния вообще, и просто должны платить запрашиваемую цену. Куда же идет остальная часть? Промышленность. Нитрометан используется для разнообразных составов - растворитель для некоторых пластмасс, производство инсектицидов, удобрений, взрывчатых веществ (да, это был компонент в бомбежке Оклахома-Сити) и это - компонент в Tagamet, известном составе для лечения язвы (неудивительно, что материал является настолько дорогим!). Пожалуйста, обратите внимание, что, в то время как нитрометан - компонент в создании некоторых взрывчатых веществ, сам по себе он не является взрывчатым веществом. (Помните - он используется в удобрениях.) Не проходит и месяца, чтобы кто-нибудь не позвонил, чтобы спросить: "Я слышал, что большее количество нитрометана будет снижать рабочую температуру моего двигателя. Это правда?" Нет. Чем выше содержание нитрометана, тем выше рабочая температура. К счастью, в большинстве наших двигателей различие в рабочей температуре между 5% и 10%-процентным топливом незначительно, и есть совокупность других факторов (надлежащее смазывание и т.д.), которые являются гораздо более важными.  Наконец, помните, мы сказали в начале, что нитрометан добавляет мощность, потому что мы можем жечь большее количество нитрометана, чем, метанола, для заданного объема воздуха? Это также означает, что чем выше содержание нитрометана в топливе, тем меньшее "расстояние" (или время полета) мы получим. В стандартном двигателе .40 размера при использовании 15% нитрометана, мы обычно получаем соотношение минута к минуте с половиной времени полета для каждой унции топлива. Парни из Формулы 1 рады получить 2 минуты из бака объемом 8 унций! Если Вы повышаете содержание нитрометана в топливе, убедитесь, что открыли иглу карбюратора на несколько щелчков прежде, чем Вы идете летать. Иначе у Вас окажется слишком бедная смесь и Вы можете повредить двигатель. Наоборот, если Вы снижаете содержание нитрометана, Вы должны будете отрегулировать карбюратор на обеднение смеси. Каков же вывод – стоит ли переходить на другой вид топлива? Высокий износ и большая прибавка мощности говорят за себя – такая доработка оправдана только если машина необходима для спортивных целей, либо для тех людей, кому нужно больше и больше мощности. В противном случае такое переоборудование не будет иметь смысла.Источник 1Источник 2
Наконец, помните, мы сказали в начале, что нитрометан добавляет мощность, потому что мы можем жечь большее количество нитрометана, чем, метанола, для заданного объема воздуха? Это также означает, что чем выше содержание нитрометана в топливе, тем меньшее "расстояние" (или время полета) мы получим. В стандартном двигателе .40 размера при использовании 15% нитрометана, мы обычно получаем соотношение минута к минуте с половиной времени полета для каждой унции топлива. Парни из Формулы 1 рады получить 2 минуты из бака объемом 8 унций! Если Вы повышаете содержание нитрометана в топливе, убедитесь, что открыли иглу карбюратора на несколько щелчков прежде, чем Вы идете летать. Иначе у Вас окажется слишком бедная смесь и Вы можете повредить двигатель. Наоборот, если Вы снижаете содержание нитрометана, Вы должны будете отрегулировать карбюратор на обеднение смеси. Каков же вывод – стоит ли переходить на другой вид топлива? Высокий износ и большая прибавка мощности говорят за себя – такая доработка оправдана только если машина необходима для спортивных целей, либо для тех людей, кому нужно больше и больше мощности. В противном случае такое переоборудование не будет иметь смысла.Источник 1Источник 2 smotra.ru
 Метиловый спирт, метанол Ch4OHМетанол является очень ядовитым веществом но все таки используется в ряде спортивных автомобилей, в случае если регламентом разрешено использование этого вида топлива. Мощность двигателя при использовании метанола будет выше на 7-9 %. без каких либо переделок кроме добавления топлива, до достижения стехиометрического состояния смеси. Стехиометрическая смесь метанола с воздухом составляет 6.4 к 1 что более чем в два раза меньше чем при использовании бензина 14.7 к 1.Октановое число метанола - 111 по исследовательскому методу ! Метиловый спирт обладает большим чем любой из бензинов октановым числом, что позволяет уверенно использовать степени сжатия превышающие 15:1 в то время как средний бензиновый мотор имеет степень сжатия около 11.5:1 Индикаторный КПД за счет уменьшенных тепловых потерь выше на несколько процентов. Учитывая возможность повышенной степени сжатия и улучшенный КПД суммарная мощность двигателя может быть выше на 20 - 30 % по сравнению с бензиновым двигателем. Стоимость литра метанола около 20 руб только купить его не так то просто и продается в основном цистернами. Нитрометан Ch4NO2Нитрометан Ch4NO2 - температура горения 4000 С. Так как в его составе имеется кислород, то при использовании его в двигателе внутреннего сгорания требуется гораздо меньше поступающего кислорода из воздуха, чтоб получить ту же самую мощность чем от бензина. На практике это выглядит так: Чтоб сжечь килограмм бензина нужно 14.7 килограмм воздуха, чтоб сжечь килограмм нитрометана нужно всего лишь 1.7 килограмма воздуха. То есть нирометана в цилиндре одного и того-же объема можно сжечь в 8.7 раза больше чем бензина. Но нитрометан имеет меньшую плотность энергии 11,3 МДж/кг вместо 42–44 МДж/кг у бензина. В итоге всех этих расчетов получается, что не нитрометане двигатель будет иметь мощность в 2.3 раза выше чем на бензине.Может показаться что нет ничего проще, заправил в бак нитрометана и вместо 200 лошадей получилось 460 !!! Да лошадей много, но температура горения 4000 градусов сначала расплавит свечи, потом раскалит клапана и двигатель перейдет на калильное зажигание, пока не прогорят клапана или поршни. Но мощность будет адская + 230% если конечно соответственно настроить двигатель, ведь нитрометана подавать нужно в 8.7 раза больше чем бензина. В связи с этим, нитрометан применяют лишь в соревнованиях самых мощных драгстеров, Top Fuel Dragster, где время работы двигателя на максимуме ограничивается 5 секундами. Также данный вид топлива используют в моделизме, как присадка, для микродвигателей использующих калильное зажигание. Стоимость нитрометана от 500 до 2500 руб за литр. Закись азота и амилнитрид |
zero-100.ru
 Те, кто не доволен серийными автомобилями, прибегает к автотюнингу. Конечно, серия доработок стандартного двигателя подразумевает увеличение мощности, но ведь всему есть предел, не так ли? Чтобы обойти это ограничение и увеличить мощность мотора не на 20-40%, а в несколько раз, применяется особый вид топлива – система закиси азота или нитрометан.
Те, кто не доволен серийными автомобилями, прибегает к автотюнингу. Конечно, серия доработок стандартного двигателя подразумевает увеличение мощности, но ведь всему есть предел, не так ли? Чтобы обойти это ограничение и увеличить мощность мотора не на 20-40%, а в несколько раз, применяется особый вид топлива – система закиси азота или нитрометан.
Использование заряженного топлива дает возможность до неузнаваемости изменить конфигурацию автомобиля. К примеру, закись азота, который является наиболее излюбленным среди уличных гонщиков, увеличивает мощность больше чем в 2 раза. Вместе с этим, растет и температура работы двигателя, что не очень хорошо сказывается на работе мотора. Пламя вырывается далеко за пределы цилиндра, да что там, оно вырывается даже из выхлопной трубы. Следует ли говорить о том, каким нагрузкам поддается двигатель?
Для использования диоксида азота двигатель подвергается доработкам. Осуществляется прокладка дополнительной топливной магистрали, которая и будет осуществлять впрыск закиси азота. Разумеется, устанавливается высокопрочная цилиндропоршневая группа, ГБЦ и выхлопная система, модернизируется система охлаждения. Автомобиль, использующий в качестве топлива азот, нуждается в техническом обслуживании каждые 1000-1500 км.
Нитрометан для машин является еще более жестким топливом, нежели диоксид азота. Мощность мотора, а вместе с нею и температура работы двигателя возрастает до 10 раз. Если говорить в мощностном эквиваленте, то автомобили, заправленные метаном, показывают результат от 3-х до 7-тысяч лошадиных сил. Но двигатель имеет ресурс работы всего в 5-8 тыс. км, так как нитрометан, буквально, сжигает его изнутри. Поэтому устанавливаются специальные, чугунные блоки, которые немного продлевают срок службы мотора.
Как правило, машинки на нитрометане – это профессиональные проекты, которые создаются специально для гонок. В эти проекты вкладываются большие деньги, над ними работают лучшие специалисты. Дело в том, что нитрометан – нестабильное топливо и имеет наивысший коэффициент взрывоопасности. Поэтому уличные гонщики не пользуются таким топливом, несмотря на то, что автомобиль и теряет пределы увеличения мощности.
Переоборудование машины под потребление диоксида азота или нитрометана имеет смысл только в случае участия в профессиональных заездах.
 Портинг – грамотный тюнинг ГБЦ
Портинг – грамотный тюнинг ГБЦ Тюнинг – популярное направление среди миллионов автолюбителей. Те, кто не доволен серийными автомобилями, кто стремится увеличить их мощность, прибегает к различным видам тюнинга. В вопросе доработки двигателя далеко не последнее, а скорее, одно из первых мест занимает тюнинг головки блока цилиндров (далее ГБЦ), так как именно от нее зависят многие мощностные показатели. Грамотная доработка ...
 Флокирование салона автомобиля своими руками
Флокирование салона автомобиля своими руками В последнее время появилось достаточно много способов как внешнего, так и внутреннего тюнинга автомобиля, преображения его экстерьера и интерьера. Это и аэрография, и нанесение виниловых пленок с различными оттенками и фактурами, это и применение аквапечати. Однако совершенно новым видом улучшения является флокирование салона. Если вы считаете, что данной процедурой могут заниматься только ...
 Регулируемая тонировка стекол автомобиля
Регулируемая тонировка стекол автомобиля С некоторых пор в России запрещено тонировать стекла автомобиля пленкой, которая пропускает менее 75% света. Разрешается лишь малая доля затемнения заднего стекла и стекол задних дверей.Передние пассажирские, а тем более лобовое стекло должны оставаться максимально прозрачными. Но не все так легко смирились с этим запретом и, на свой страх и риск продолжают ездить со всеми тонированными ...
pro-tachku.ru
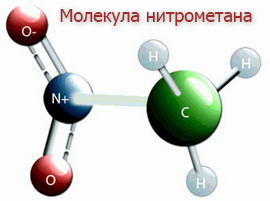
Нитромета́н — химическое соединение с формулой СН3-NO2. Простейший представитель нитросоединений алифатического ряда. Нитрометан следует отличать от метилнитрата (эфира метилового спирта и азотной кислоты с формулой СН3NO3) и изомерного ему метилнитрита с той же брутто-формулой СН3ONO.
| Нитрометан | |
 | |
 | |
| нитрометан | |
| Ch4NO2 | |
| бесцветная жидкость | |
| 61 г/моль | |
| 1,138 г/см³ | |
| 0.61 мПа·с | |
| 11,08±0,01 эВ[2] | |
| -28,5 °C | |
| 101,2 °C | |
| 36 °C | |
| 7,3±0,1 об.%[2] | |
| 244,6 К, 1,4015·102 Па | |
| 588,15 К, 6,3·106 Па[1] | |
| -113,1 кДж/моль | |
| 38,28 Дж/кг | |
| 9,7 Дж/кг | |
| 36,4 гПа (20 °C) | |
| 10.2 | |
| 10.5 г/100 мл | |
| 1,3817 | |
| 3,50 Д | |
| 75-52-5 | |
| 6375 | |
| 200-876-6 | |
| PA9800000 | |
| 77701 | |
| 6135 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Нитрометан представляет собой бесцветную высокополярную жидкость(ε=35,87), имеющую запах горького миндаля. Ограниченно растворим в воде — 10,5 г на 100 г воды, и растворяет 1,93 г воды в 100 г нитрометана, смешивается с обычными органическими растворителями; образует азеотропную смесь с водой (76,4 % нитрометана, tкип=83,6 °C)[3]. Не растворяется в предельных углеводородах. Максимальная температура горения 2177 °C при дефлаграции - реакции взрывного горения[4]:
Ch4NO2→0,2CO2+0,8h3O+0,7h3+0,5N2{\displaystyle {\mathsf {CH_{3}NO_{2}\rightarrow 0,2CO_{2}+0,8H_{2}O+0,7H_{2}+0,5N_{2}}}}Нитрометан горит желтым пламенем.
Исследования молекулы нитрометана показали, что во фрагменте C-NO2 все атомы расположены в одной плоскости, при этом угол связи O-N-O составляет 127±3°, в то время как угол связи C-N-O — 116±3°. Различие в величине угла объясняется взаимным отталкиванием отрицательно заряженных атомов кислорода[5].
Нитрометан горюч и взрывоопасен. При соблюдении условий хранения может храниться при комнатной температуре неограниченно долго.
Благодаря наличию нитрогруппы атомы водорода в нитрометане подвижны, могут отщепляться в растворе при действии оснований (pKa = 10,2).
Ch4NO2+NaOH→Ch3=N(O)ONa+h3O{\displaystyle {\mathsf {CH_{3}NO_{2}+NaOH\rightarrow CH_{2}{\text{=}}N(O)ONa+H_{2}O}}}Нитрометан вступает во взаимодействие с кетонами, альдегидами в так называемой нитральдольной реакции или реакции Анри,
например с формальдегидом
Ch4NO2+HCHO→HOCh3Ch3NO2{\displaystyle {\mathsf {CH_{3}NO_{2}+HCHO\rightarrow HOCH_{2}CH_{2}NO_{2}}}}При использовании избытка формальдегида замещаются все три атома водорода и образуется три(гидроксиметилен)нитрометан
Ch4NO2+3HCHO→(HOCh3)3CNO2{\displaystyle {\mathsf {CH_{3}NO_{2}+3HCHO\rightarrow (HOCH_{2})_{3}CNO_{2}}}}который при восстановлении образует (Ch3OH)3CNh3 — три(гидроксиметилен)метиламин («tris»), основной компонент трис-буфера.
Нитрометан также выступает как донор в реакции Михаэля, присоединясь к α,β-непредельным соединения по схеме 1,4-присоединения.
Взаимодействует с окисью этилена, и др. соединениями.
При замещении нитрогруппами других атомов водорода нитрометан образует динитрометан (СН2(NO2)2), тринитрометан (СН(NO2)3) и тетранитрометан (С(NO2)4). Все эти соединения также являются взрывчатыми веществами.
Нитрометан может быть использован как монотопливо, то есть топливо, способное гореть в отсутствие кислорода. В числе продуктов сгорания могут быть угарный и углекислый газ, вода, молекулярный азот и оксиды азота. Уравнение этой реакции может быть представлено как:
4Ch4NO2→4CO+4h3O+2h3+2N2{\displaystyle {\mathsf {4CH_{3}NO_{2}\rightarrow 4CO+4H_{2}O+2H_{2}+2N_{2}}}}Скорость ламинарного горения паров нитрометана составляет 0,5 м/с (немного выше чем у бензина), что делает его перспективным топливом для высокоскоростных двигателей. Кроме того, температура пламени несколько выше — 2400 °C. Высокая удельная теплота парообразования (0,56 МДж/кг) вместе с высокой скоростью течения приводит к сильному охлаждению подходящего топлива (примерно вдвое больше, чем у метанола), в результате получаются довольно низкие температуры.
Благодаря наличию кислорода в нитрометане он может гореть с много меньшим количеством атмосферного воздуха по сравнению с углеводородными топливами (бензин, керосин):
4Ch4NO2+3O2→4CO2+6h3O+2N2{\displaystyle {\mathsf {4CH_{3}NO_{2}+3O_{2}\rightarrow 4CO_{2}+6H_{2}O+2N_{2}}}}14,7 кг воздуха необходимо для сжигания килограмма бензина, но только 1,7 кг воздуха на один килограмм нитрометана. Так как цилиндр двигателя может содержать только ограниченное количество воздуха при каждом такте, в 8,7 раз больше нитрометана по сравнению с бензином может быть сожжено в один такт. Нитрометан, однако, имеет меньшую плотность энергии: бензин выделяет около 42-44 МДж/кг в то время как, нитрометан даёт 11,3 МДж/кг. Этот расчёт показывает, что нитрометан производит примерно в 2,3 раза больше мощности по сравнению с обычным топливом.
Нитрометан часто используют в богатых воздушно-топливных смесях, поскольку он даёт энергию даже при отсутствии атмосферного кислорода. При использовании богатой воздушно-топливной смеси, часть продуктов сгорания — водород и монооксид углерода. Эти газы часто воспламеняются, иногда впечатляюще, когда очень богатые смеси ещё горящего топлива покидают выхлопные трубы. Очень богатые смеси необходимы, чтобы снизить температуру камеры сгорания, для управления предварительным зажиганием и устранения возможной детонации.
Небольшое количество гидразина, смешанное с нитрометаном, может ещё больше увеличить выдаваемую мощность. Гидразин образует с нитрометаном взрывоопасную соль, тоже монотопливо. Из-за опасности взрыва эта смесь запрещена к применению как авиамодельное топливо.
В авиамоделизме и автомобильном калильном топливе основной ингредиент обычно метанол, с небольшой добавкой нитрометана (от 0 % до 65 %, но редко больше 30 %, так как нитрометан дороже метанола) и 10-20 % смазки (обычно касторовое масло и/или синтетическое масло). Даже умеренные количества нитрометана приводят к увеличению мощности, выдаваемой двигателем (поскольку обычно ограничивающий фактор — приток воздуха), упрощая настройку двигателя (оптимизацию соотношения воздух/топливо).
Нитрометан как взрывоопасное вещество привлёк особое внимание в 1958 году, когда с разницей в полгода в США произошли взрывы цистерн с нитрометаном при транспортировке по железной дороге. До этого нитрометан считался горючей, но не взрывоопасной жидкостью[6][7].
Нитрометан замораживают, образующиеся кристаллы промывают диэтиловым эфиром, затем перегоняют.
Нитрометан ядовит: при вдыхании паров или проглатывании поражает печень и почки, центральную нервную систему. Наркотик, обладающий также судорожным действием и последействием.
Нитрометан в концентрации 40% или более считается прекурсором (Таблица III), оборот которого в Российской Федерации ограничен.
ru-wiki.org