







 Патогенез ДВС синдрома
Патогенез ДВС синдрома
 Каждый человек встречается с ДВС синдромом как минимум дважды: когда рождается и когда умирает. А. И. Воробьев Нитью фибрина начинается и заканчивается жизнь человека.
Каждый человек встречается с ДВС синдромом как минимум дважды: когда рождается и когда умирает. А. И. Воробьев Нитью фибрина начинается и заканчивается жизнь человека.
 ДВС синдром - синдром полиорганной недостаточности, в основе которого лежит внутрисосудистая активация коагуляции, ведущая к блокаде микроциркуляции рыхлыми массами фибрина и агрегатами клеток, с потреблением про- и антикоагулянтов, что может сопровождается клиникой тромбозов и геморрагий. Н. П. Шабалов
ДВС синдром - синдром полиорганной недостаточности, в основе которого лежит внутрисосудистая активация коагуляции, ведущая к блокаде микроциркуляции рыхлыми массами фибрина и агрегатами клеток, с потреблением про- и антикоагулянтов, что может сопровождается клиникой тромбозов и геморрагий. Н. П. Шабалов
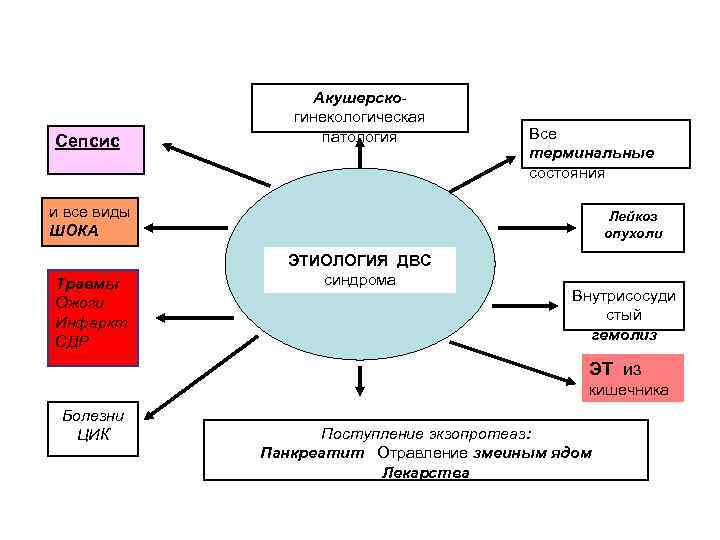 Сепсис Акушерскогинекологическая патология и все виды ШОКА Травмы Ожоги Инфаркт СДР Все терминальные состояния Лейкоз опухоли ЭТИОЛОГИЯ ДВС синдрома Внутрисосуди стый гемолиз ЭТ из кишечника Болезни ЦИК Поступление экзопротеаз: Панкреатит Отравление змеиным ядом Лекарства
Сепсис Акушерскогинекологическая патология и все виды ШОКА Травмы Ожоги Инфаркт СДР Все терминальные состояния Лейкоз опухоли ЭТИОЛОГИЯ ДВС синдрома Внутрисосуди стый гемолиз ЭТ из кишечника Болезни ЦИК Поступление экзопротеаз: Панкреатит Отравление змеиным ядом Лекарства
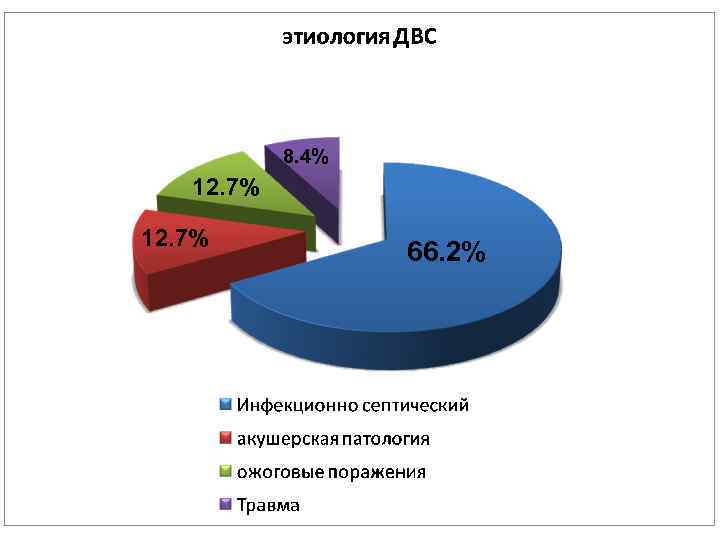 8. 4% 12. 7% 66. 2%
8. 4% 12. 7% 66. 2%
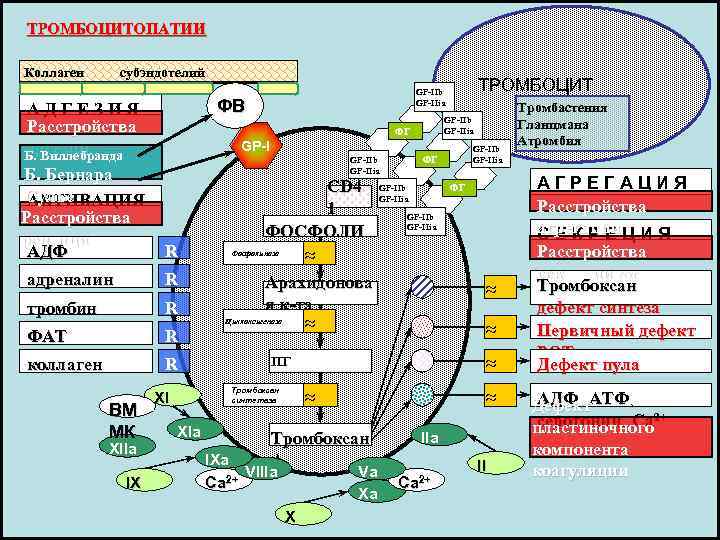 ТРОМБОЦИТОПАТИИ Коллаген субэндотелий А Д Г Е З И Я Расстройства адгезии Б. Виллебранда Б. Бернара Сулье АКТИВАЦИЯ Расстройства рецепции АДФ ФВ GP-I R тромбин R ФАТ R коллаген R IX CD 4 1 ФОСФОЛИ Фосфолипаза ПИДЫ XIa ФГ GP-IIb GP-IIia Арахидонова я к-та Циклоксигеназа ПГ Тромбоксан синтетаза XI Тромбоксан А 2 IXa VIIIa Ca 2+ Va Xa X GP-IIb GP-IIia ФГ GP-IIb GP-IIia R XIIa GP-IIb GP-IIia ФГ адреналин ВМ МК ТРОМБОЦИТ GP-IIb GP-IIia IIa Ca 2+ II Тромбастения Гланцмана Атромбия А Г Р Е Г А Ц И Я Расстройства агрегации С Е К Р Е Ц И Я Расстройства секреции РОТ Тромбоксан дефект синтеза тромбоксана Первичный дефект РОТ Дефект пула хранения АДФ¸ АТФ¸ Дефект серотонин¸ Са 2+ пластиночного компонента коагуляции
ТРОМБОЦИТОПАТИИ Коллаген субэндотелий А Д Г Е З И Я Расстройства адгезии Б. Виллебранда Б. Бернара Сулье АКТИВАЦИЯ Расстройства рецепции АДФ ФВ GP-I R тромбин R ФАТ R коллаген R IX CD 4 1 ФОСФОЛИ Фосфолипаза ПИДЫ XIa ФГ GP-IIb GP-IIia Арахидонова я к-та Циклоксигеназа ПГ Тромбоксан синтетаза XI Тромбоксан А 2 IXa VIIIa Ca 2+ Va Xa X GP-IIb GP-IIia ФГ GP-IIb GP-IIia R XIIa GP-IIb GP-IIia ФГ адреналин ВМ МК ТРОМБОЦИТ GP-IIb GP-IIia IIa Ca 2+ II Тромбастения Гланцмана Атромбия А Г Р Е Г А Ц И Я Расстройства агрегации С Е К Р Е Ц И Я Расстройства секреции РОТ Тромбоксан дефект синтеза тромбоксана Первичный дефект РОТ Дефект пула хранения АДФ¸ АТФ¸ Дефект серотонин¸ Са 2+ пластиночного компонента коагуляции
 СХЕМА МАТРИЧНОГО ВЗАИМОДЕЙСТВИЯ ФАКТОРОВ СВЕРТЫВАНИЯ КРОВИ Ф Xa Ф IXa Протромбин Тромбин ФX 1. Каскадность Ф Vт Ф VIIIт 2. Усиление 3. Управляемость 4. Самоограничение Ca 2+ Ca 2+ 3 ф - фосфолипид - матрица Ca 2+ 5. Полифункциональность 6. Матрица - локальность
СХЕМА МАТРИЧНОГО ВЗАИМОДЕЙСТВИЯ ФАКТОРОВ СВЕРТЫВАНИЯ КРОВИ Ф Xa Ф IXa Протромбин Тромбин ФX 1. Каскадность Ф Vт Ф VIIIт 2. Усиление 3. Управляемость 4. Самоограничение Ca 2+ Ca 2+ 3 ф - фосфолипид - матрица Ca 2+ 5. Полифункциональность 6. Матрица - локальность
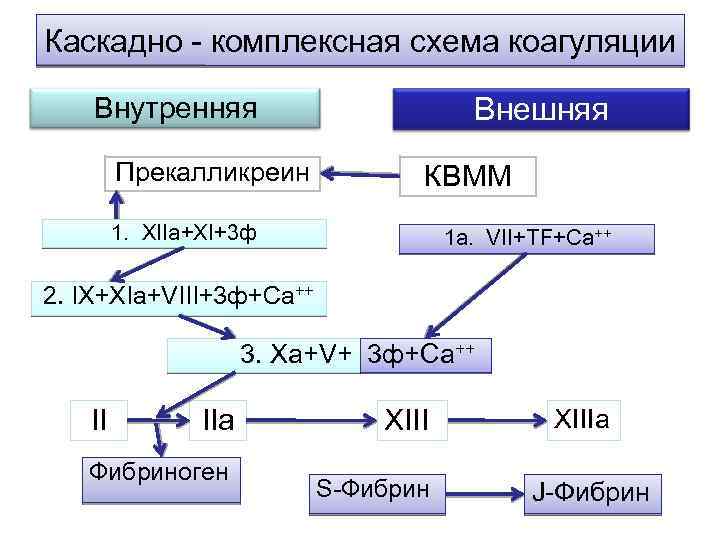 Каскадно - комплексная схема коагуляции Внешняя Внутренняя Прекалликреин КВММ 1. XIIa+XI+3 ф 1 а. VII+TF+Ca++ 2. IX+XIa+VIII+3 ф+Ca++ 3. Xa+V+ 3 ф+Са++ II IIa Фибриноген XIII S-Фибрин XIIIa J-Фибрин
Каскадно - комплексная схема коагуляции Внешняя Внутренняя Прекалликреин КВММ 1. XIIa+XI+3 ф 1 а. VII+TF+Ca++ 2. IX+XIa+VIII+3 ф+Ca++ 3. Xa+V+ 3 ф+Са++ II IIa Фибриноген XIII S-Фибрин XIIIa J-Фибрин
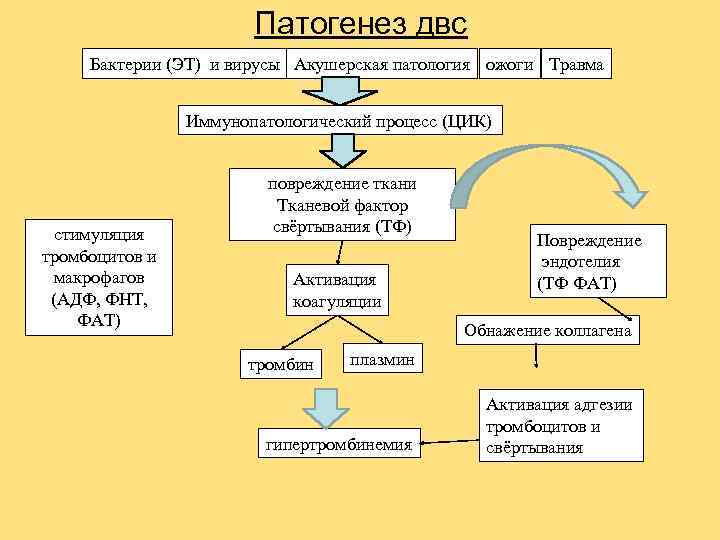 Патогенез двс Бактерии (ЭТ) и вирусы Акушерская патология ожоги Травма Иммунопатологический процесс (ЦИК) стимуляция тромбоцитов и макрофагов (АДФ, ФНТ, ФАТ) повреждение ткани Тканевой фактор свёртывания (ТФ) Активация коагуляции Повреждение эндотелия (ТФ ФАТ) Обнажение коллагена тромбин плазмин гипертромбинемия Активация адгезии тромбоцитов и свёртывания
Патогенез двс Бактерии (ЭТ) и вирусы Акушерская патология ожоги Травма Иммунопатологический процесс (ЦИК) стимуляция тромбоцитов и макрофагов (АДФ, ФНТ, ФАТ) повреждение ткани Тканевой фактор свёртывания (ТФ) Активация коагуляции Повреждение эндотелия (ТФ ФАТ) Обнажение коллагена тромбин плазмин гипертромбинемия Активация адгезии тромбоцитов и свёртывания
 Эффекты эндотоксина ( ЭТЛПС) Активация обоих путей коагуляции Активация ФНО Стимуляция ПГЕ Активация агрегации клеток Генерализованное повреждение эндотелия Стимуляция Вл¸ Ig. M¸ЦИК ЭТ Либератор гистамина Активация С 3 Hardway 1 обратимый Торможение (ранний¸ оздний¸ фибринолитической устойчивый) 2. Необратимый активности в коре почек иммуносупрессия Активация ПМЯ¸ Мф ИЛ 1¸ ИЛ 8¸ ИЛ 6 Освобождение эластазы и лизосомальных гидролаз Терапия: зависит от ВИДА шока и Стимуляция дыхательного стадии анальгетики¸ восполнение объема или крови¸ взрыва Н 2 О 2 допамин¸ О 2 ¸ сода¸ глюкокортикоиды¸ Инфаркт коры антиаритмические¸ электролиты¸ глюкоза¸ Стимуляция апоптоза надпочечников инсулин¸ гепарин ¸ диуретики¸ кокарбоксилаза ИВЛ¸ АИК
Эффекты эндотоксина ( ЭТЛПС) Активация обоих путей коагуляции Активация ФНО Стимуляция ПГЕ Активация агрегации клеток Генерализованное повреждение эндотелия Стимуляция Вл¸ Ig. M¸ЦИК ЭТ Либератор гистамина Активация С 3 Hardway 1 обратимый Торможение (ранний¸ оздний¸ фибринолитической устойчивый) 2. Необратимый активности в коре почек иммуносупрессия Активация ПМЯ¸ Мф ИЛ 1¸ ИЛ 8¸ ИЛ 6 Освобождение эластазы и лизосомальных гидролаз Терапия: зависит от ВИДА шока и Стимуляция дыхательного стадии анальгетики¸ восполнение объема или крови¸ взрыва Н 2 О 2 допамин¸ О 2 ¸ сода¸ глюкокортикоиды¸ Инфаркт коры антиаритмические¸ электролиты¸ глюкоза¸ Стимуляция апоптоза надпочечников инсулин¸ гепарин ¸ диуретики¸ кокарбоксилаза ИВЛ¸ АИК
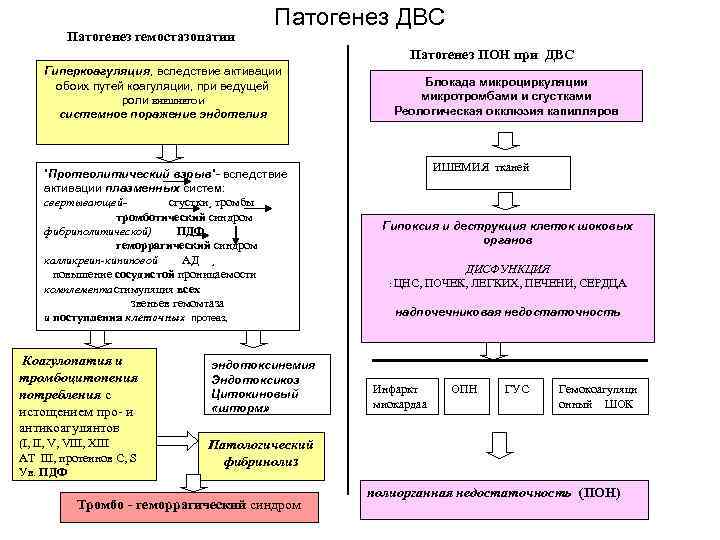 Патогенез гемостазопатии Патогенез ДВС Патогенез ПОН при ДВС Гиперкоагуляция, вследствие активации обоих путей коагуляции, при ведущей роли ВНЕШНЕГО и системное поражение эндотелия ”Протеолитический взрыв”- вследствие активации плазменных систем: свертывающей- сгустки¸ тромбы тромботический синдром фибринолитической) ПДФ геморрагический синдром калликреин-кининовой АД ¸ повышение сосудистой проницаемости комплементастимуляция всех звеньев гемомтаза и поступления клеточных протеаз Коагулопатия и тромбоцитопения потребления с истощением про- и антикоагулянтов (I II V VIII XIII АТ III протеинов C S Ув. ПДФ эндотоксинемия Эндотоксикоз Цитокиновый «шторм» Блокада микроциркуляции микротромбами и сгустками Реологическая окклюзия капилляров ИШЕМИЯ тканей Гипоксия и деструкция клеток шоковых органов ДИСФУНКЦИЯ : ЦНС, ПОЧЕК, ЛЕГКИХ, ПЕЧЕНИ, СЕРДЦА надпочечниковая недостаточность Инфаркт миокардаа ОПН ГУС Гемокоагуляци онный ШОК Патологический фибринолиз Тромбо - геморрагический синдром полиорганная недостаточность (ПОН)
Патогенез гемостазопатии Патогенез ДВС Патогенез ПОН при ДВС Гиперкоагуляция, вследствие активации обоих путей коагуляции, при ведущей роли ВНЕШНЕГО и системное поражение эндотелия ”Протеолитический взрыв”- вследствие активации плазменных систем: свертывающей- сгустки¸ тромбы тромботический синдром фибринолитической) ПДФ геморрагический синдром калликреин-кининовой АД ¸ повышение сосудистой проницаемости комплементастимуляция всех звеньев гемомтаза и поступления клеточных протеаз Коагулопатия и тромбоцитопения потребления с истощением про- и антикоагулянтов (I II V VIII XIII АТ III протеинов C S Ув. ПДФ эндотоксинемия Эндотоксикоз Цитокиновый «шторм» Блокада микроциркуляции микротромбами и сгустками Реологическая окклюзия капилляров ИШЕМИЯ тканей Гипоксия и деструкция клеток шоковых органов ДИСФУНКЦИЯ : ЦНС, ПОЧЕК, ЛЕГКИХ, ПЕЧЕНИ, СЕРДЦА надпочечниковая недостаточность Инфаркт миокардаа ОПН ГУС Гемокоагуляци онный ШОК Патологический фибринолиз Тромбо - геморрагический синдром полиорганная недостаточность (ПОН)
 ПАТОГЕНЕЗ ГЕМОРРАГИЧЕСКОГО СИНДРОМА при ДВС(нарушения 3 -х звеньев системы гемостаза) • Генерализованное повреждение эндотелия эндотоксином и ФНОα сосудистое Гиперагрегация (адреналин, Тх. II, тромбин. АДФ) тромбоцитарное Блокада микроциркуляции гипоксия плазменное Активация протеаз Дистрофия сосудистой стенки, локальный ацидоз Повреждение мембран тромбоцитов 1. Тромбинемия 2. коагулопатия потребления 3. печеночная недостаточность 4. реактивная а затем патологическая активация фибринолиза 5. ПДФ - антикоагулянты Тромбоцитопения потребления
ПАТОГЕНЕЗ ГЕМОРРАГИЧЕСКОГО СИНДРОМА при ДВС(нарушения 3 -х звеньев системы гемостаза) • Генерализованное повреждение эндотелия эндотоксином и ФНОα сосудистое Гиперагрегация (адреналин, Тх. II, тромбин. АДФ) тромбоцитарное Блокада микроциркуляции гипоксия плазменное Активация протеаз Дистрофия сосудистой стенки, локальный ацидоз Повреждение мембран тромбоцитов 1. Тромбинемия 2. коагулопатия потребления 3. печеночная недостаточность 4. реактивная а затем патологическая активация фибринолиза 5. ПДФ - антикоагулянты Тромбоцитопения потребления
 Эффекты тромбина • Образование фибрина фибриногена и ф. II • Агрегация тромбоцитов количества тромбоцитов • Активация ф. V и ФVII уровня ФV и ФVII • Активация ФХIII • Активация системы протеина C и S (ПС/ПS) уровня ПС/ПS активация фибринолитическй системы
Эффекты тромбина • Образование фибрина фибриногена и ф. II • Агрегация тромбоцитов количества тромбоцитов • Активация ф. V и ФVII уровня ФV и ФVII • Активация ФХIII • Активация системы протеина C и S (ПС/ПS) уровня ПС/ПS активация фибринолитическй системы
 Эффекты плазмина • • • Деградация фибрина ПДФ Деградация фибриногена уровня ф. V и ф. VIII содержания Протеолиз ФВ ФХII и ФХI содержания Протеолиз ФХIII его уровня Изменения в ГП тромбоцитарной мб
Эффекты плазмина • • • Деградация фибрина ПДФ Деградация фибриногена уровня ф. V и ф. VIII содержания Протеолиз ФВ ФХII и ФХI содержания Протеолиз ФХIII его уровня Изменения в ГП тромбоцитарной мб
 Патогенез геморрагий при ДВС • 1. Блокада микроциркуляторного русла сгустками фибрина, агрегатами клеток крови и ПДФ • 2. дистрофия стенок капилляров • 3. сладж- феномен • 4. гипоксически- ишемическое повреждение мембран • 5. ацидоз • 6. тромбоцитопения потребления (нарушение трофики эндотелиоцитов и сосудисто- тромбоцитарного гемостаза • 7. потребление плазменных прокоагулянтов • 8. потребление антикоагулянтов (АТ III, prot. C, S).
Патогенез геморрагий при ДВС • 1. Блокада микроциркуляторного русла сгустками фибрина, агрегатами клеток крови и ПДФ • 2. дистрофия стенок капилляров • 3. сладж- феномен • 4. гипоксически- ишемическое повреждение мембран • 5. ацидоз • 6. тромбоцитопения потребления (нарушение трофики эндотелиоцитов и сосудисто- тромбоцитарного гемостаза • 7. потребление плазменных прокоагулянтов • 8. потребление антикоагулянтов (АТ III, prot. C, S).
 Патогенез полиорганной недостаточности при ШОКЕ (ПОН) Ишемия Гипоксия Дефицит АТФ Ишемия ЖКТ ЭТ -▼ Триггер ПОН Медиаторы SIRS Цитокиновый шторм ПОН Метаболические расстройства: ацидоз ДВС Блокада микроциркуляции сгустками тромбами Реперфузия Активация Мф Цитокины Ферменты NO
Патогенез полиорганной недостаточности при ШОКЕ (ПОН) Ишемия Гипоксия Дефицит АТФ Ишемия ЖКТ ЭТ -▼ Триггер ПОН Медиаторы SIRS Цитокиновый шторм ПОН Метаболические расстройства: ацидоз ДВС Блокада микроциркуляции сгустками тромбами Реперфузия Активация Мф Цитокины Ферменты NO
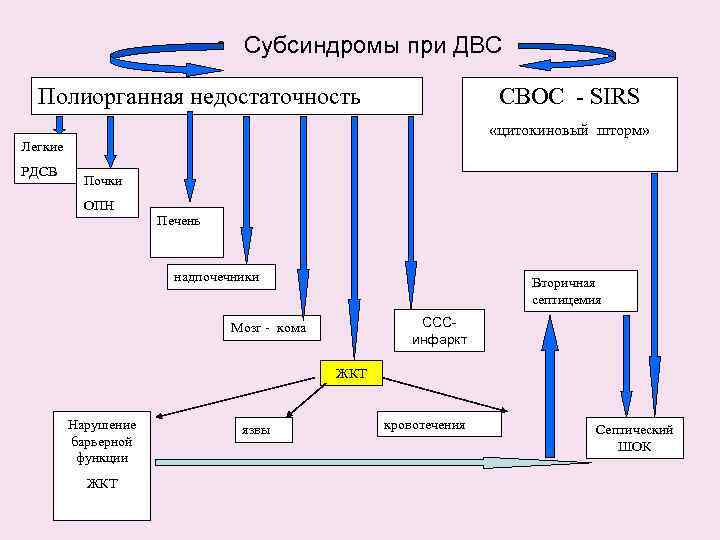 • Субсиндромы при ДВС Полиорганная недостаточность СВОС - SIRS «цитокиновый шторм» Легкие РДСВ Почки ОПН Печень надпочечники Вторичная септицемия СССинфаркт Мозг - кома ЖКТ Нарушение барьерной функции ЖКТ язвы кровотечения Септический ШОК
• Субсиндромы при ДВС Полиорганная недостаточность СВОС - SIRS «цитокиновый шторм» Легкие РДСВ Почки ОПН Печень надпочечники Вторичная септицемия СССинфаркт Мозг - кома ЖКТ Нарушение барьерной функции ЖКТ язвы кровотечения Септический ШОК
 Ведущие звенья патогенеза ДВС синдрома : 1) ”Протеолитический взрыв” - чрезмерное образование тромбина и плазмина в крови вазоактивный эффект кининов, активация комплемента, «цитокиновый шторм» поступление клеточных протеаз патологический фибринолиз. 2) Системное поражение эндотелия вследствие ацидоза, эндотоксикоза, экзотоксикоза, гиперцитокинемии. 3) Гиперкоагуляция, связанная с активацией как внутреннего, так и внешнего путей коагуляции, при ведущей роли внешнего; 3) Блокада микроциркуляции на ранних стадиях ДВС за счет образования растворимых комплексов фибриноген (РФМК) и развития фибриновых микротромбов и далее реологической окклюзии капилляров (повышение вязкости крови - сладж, сгустки). 5) Гипоксия и деструкция клеток с дисфункцией: ЦНС, почек, легких, печени, сердца -”полиорганная недостаточность ”. 6) Коагулопатия и тромбоцитопения потребления с истощением в крови уровней как прокоагулянтов (I II V VIII XIII f W) так и естественных антикоагулянтов-ингибиторов активных сериновых протеаз (АТ III протеины C S и др. ). По мнению многих авторов, обеднение крови факторами свертывания, по крайней мере, во II стадии ДВС-синдрома, является скорее результатом удержания их в ретикулоэндотелии, чем потреблением при образовании внутрисосудистых тромбов. 7) Патологический фибринолиз со значительным повышением ПДФ деградацией фибриногена протеолизом V VIII XI XIII f W изменениями в гликопротеинах тромбоцитарной мембраны что нарушает как первичные так и вторичный гемостаз приводя к одновременному и последовательному развитию, как тромбозов так и склонности к кровотечению.
Ведущие звенья патогенеза ДВС синдрома : 1) ”Протеолитический взрыв” - чрезмерное образование тромбина и плазмина в крови вазоактивный эффект кининов, активация комплемента, «цитокиновый шторм» поступление клеточных протеаз патологический фибринолиз. 2) Системное поражение эндотелия вследствие ацидоза, эндотоксикоза, экзотоксикоза, гиперцитокинемии. 3) Гиперкоагуляция, связанная с активацией как внутреннего, так и внешнего путей коагуляции, при ведущей роли внешнего; 3) Блокада микроциркуляции на ранних стадиях ДВС за счет образования растворимых комплексов фибриноген (РФМК) и развития фибриновых микротромбов и далее реологической окклюзии капилляров (повышение вязкости крови - сладж, сгустки). 5) Гипоксия и деструкция клеток с дисфункцией: ЦНС, почек, легких, печени, сердца -”полиорганная недостаточность ”. 6) Коагулопатия и тромбоцитопения потребления с истощением в крови уровней как прокоагулянтов (I II V VIII XIII f W) так и естественных антикоагулянтов-ингибиторов активных сериновых протеаз (АТ III протеины C S и др. ). По мнению многих авторов, обеднение крови факторами свертывания, по крайней мере, во II стадии ДВС-синдрома, является скорее результатом удержания их в ретикулоэндотелии, чем потреблением при образовании внутрисосудистых тромбов. 7) Патологический фибринолиз со значительным повышением ПДФ деградацией фибриногена протеолизом V VIII XI XIII f W изменениями в гликопротеинах тромбоцитарной мембраны что нарушает как первичные так и вторичный гемостаз приводя к одновременному и последовательному развитию, как тромбозов так и склонности к кровотечению.
 Лечение больных с ДВС-синдромом – искусство, основанное на сочетании знаний, умения наблюдать и замечать, анализировать и синтезировать, оперативно принимать решение и оценивать “обратную связь” – ответ больного на терапию.
Лечение больных с ДВС-синдромом – искусство, основанное на сочетании знаний, умения наблюдать и замечать, анализировать и синтезировать, оперативно принимать решение и оценивать “обратную связь” – ответ больного на терапию.
 ПРИНЦИПЫ И ТЕРАПИИ ДВС. 1. Ситуационная оценка: ШОК, сепсис, акушерская патология и т п – возможность ДВС 2. Этиотропная терапия (противошоковая, антибиотики при сепсисе и т д) 3. СЗП на любой стадии ДВС восстанавливает дефицит про- и антикоагулянтов. 4. Деблокада микроциркуляции. Низкомолекулярные гепарины (надропарин - фраксипарин) 5. Восполнение объема при шоках 6. Возмещение дефицита эритроцитов и тромбоцитов 7. . С 1 -ИН при сепсисе блокирует и комплемент и кинины и Х!!ф, предотвращая васкулит (особенно при менингококцемии) 8. Протеин S (особенно при септическом ДВС) 9. Борьба с ОПН, ДН, СН 10. Дезинтоксикационная терапия.
ПРИНЦИПЫ И ТЕРАПИИ ДВС. 1. Ситуационная оценка: ШОК, сепсис, акушерская патология и т п – возможность ДВС 2. Этиотропная терапия (противошоковая, антибиотики при сепсисе и т д) 3. СЗП на любой стадии ДВС восстанавливает дефицит про- и антикоагулянтов. 4. Деблокада микроциркуляции. Низкомолекулярные гепарины (надропарин - фраксипарин) 5. Восполнение объема при шоках 6. Возмещение дефицита эритроцитов и тромбоцитов 7. . С 1 -ИН при сепсисе блокирует и комплемент и кинины и Х!!ф, предотвращая васкулит (особенно при менингококцемии) 8. Протеин S (особенно при септическом ДВС) 9. Борьба с ОПН, ДН, СН 10. Дезинтоксикационная терапия.
 Стадии ДВС-синдрома 1 - гиперкоагуляция ( укорочение времени АЧТВ, ПТВ, положительные паракоагуляционные тесты, фрагментация эритроцитов в мазке, возможно снижение агрегационной функции тромбоцитов и активация фибринолиза). 2 - переходная (с нарастающей коагулопатией и тромбоцитопенией, характеризуется разнонаправленными сдвигами в общекоагуляционных тестах. Тромбоэластограмма – указывает гипокоагуляцию, а паракоагуляционные тесты – гиперкоагуляцю. ). 3 - гипокоагуляция (удлинение времени всех общекоагуляционных тестов вплоть до несвертывания крови), тромбоцитопения, анемия, дефицит фибриногена, АТ 111, протеинов С и S, патологический фибринолиз. Кровотечения из мест инъекций. 4 – восстановительная (или при неблагоприятном течении фаза исходов и осложнений).
Стадии ДВС-синдрома 1 - гиперкоагуляция ( укорочение времени АЧТВ, ПТВ, положительные паракоагуляционные тесты, фрагментация эритроцитов в мазке, возможно снижение агрегационной функции тромбоцитов и активация фибринолиза). 2 - переходная (с нарастающей коагулопатией и тромбоцитопенией, характеризуется разнонаправленными сдвигами в общекоагуляционных тестах. Тромбоэластограмма – указывает гипокоагуляцию, а паракоагуляционные тесты – гиперкоагуляцю. ). 3 - гипокоагуляция (удлинение времени всех общекоагуляционных тестов вплоть до несвертывания крови), тромбоцитопения, анемия, дефицит фибриногена, АТ 111, протеинов С и S, патологический фибринолиз. Кровотечения из мест инъекций. 4 – восстановительная (или при неблагоприятном течении фаза исходов и осложнений).

 Ведущие звенья патогенеза ДВС синдрома : 1) ”Протеолитический взрыв” - чрезмерное образование тромбина и плазмина в крови вазоактивный эффект кининов, активация комплемента, «цитокиновый шторм» поступление клеточных протеаз патологический фибринолиз. 2) Системное поражение эндотелия гиперцитокинемии. вследствие ацидоза, эндотоксикоза, экзотоксикоза, 3) Гиперкоагуляция, связанная с активацией как внутреннего, так и внешнего путей коагуляции, при ведущей роли внешнего; 3) Блокада микроциркуляции на ранних стадиях ДВС за счет образования растворимых комплексов фибрин-фибриноген и развития фибриновых микротромбов и далее реологической окклюзии капилляров (повышение вязкости крови - сладж, сгустки). 5) Гипоксия и деструкция клеток с дисфункцией: ЦНС, почек, легких, печени, сердца -”полиорганная недостаточность ”. 6) Коагулопатия и тромбоцитопения потребления с истощением в крови уровней как прокоагулянтов (I II V VIII XIII f W) так и естественных антикоагулянтов-ингибиторов активных сериновых протеаз (АТ III протеины C S и др. ). По мнению многих авторов, обеднение крови факторами свертывания, по крайней мере, во II стадии ДВС-синдрома, является скорее результатом удержания их в ретикулоэндотелии, чем потреблением при образовании внутрисосудистых тромбов. 7) Патологический фибринолиз со значительным повышением ПДФ деградацией фибриногена протеолизом V VIII XI XIII f W изменениями в гликопротеинах тромбоцитарной мембраны что нарушает как первичные так и вторичный гемостаз приводя к одновременному и последовательному развитию, как тромбозов так и склонности к кровотечению.
Ведущие звенья патогенеза ДВС синдрома : 1) ”Протеолитический взрыв” - чрезмерное образование тромбина и плазмина в крови вазоактивный эффект кининов, активация комплемента, «цитокиновый шторм» поступление клеточных протеаз патологический фибринолиз. 2) Системное поражение эндотелия гиперцитокинемии. вследствие ацидоза, эндотоксикоза, экзотоксикоза, 3) Гиперкоагуляция, связанная с активацией как внутреннего, так и внешнего путей коагуляции, при ведущей роли внешнего; 3) Блокада микроциркуляции на ранних стадиях ДВС за счет образования растворимых комплексов фибрин-фибриноген и развития фибриновых микротромбов и далее реологической окклюзии капилляров (повышение вязкости крови - сладж, сгустки). 5) Гипоксия и деструкция клеток с дисфункцией: ЦНС, почек, легких, печени, сердца -”полиорганная недостаточность ”. 6) Коагулопатия и тромбоцитопения потребления с истощением в крови уровней как прокоагулянтов (I II V VIII XIII f W) так и естественных антикоагулянтов-ингибиторов активных сериновых протеаз (АТ III протеины C S и др. ). По мнению многих авторов, обеднение крови факторами свертывания, по крайней мере, во II стадии ДВС-синдрома, является скорее результатом удержания их в ретикулоэндотелии, чем потреблением при образовании внутрисосудистых тромбов. 7) Патологический фибринолиз со значительным повышением ПДФ деградацией фибриногена протеолизом V VIII XI XIII f W изменениями в гликопротеинах тромбоцитарной мембраны что нарушает как первичные так и вторичный гемостаз приводя к одновременному и последовательному развитию, как тромбозов так и склонности к кровотечению.
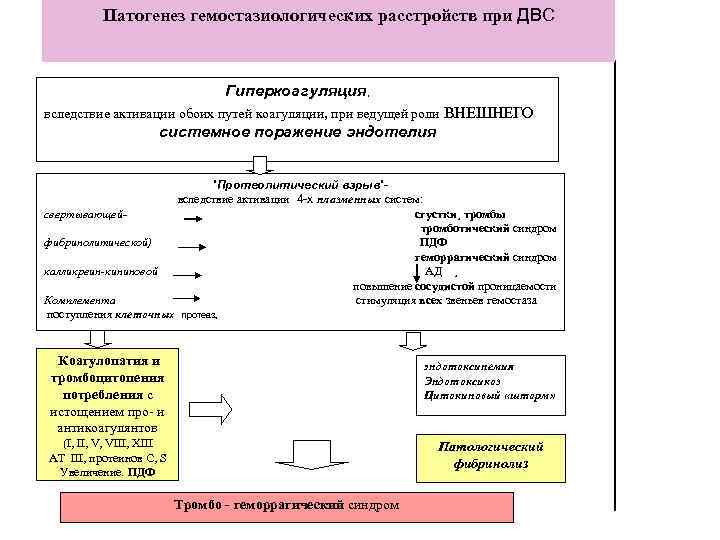 Патогенез гемостазиологических расстройств при ДВС Гиперкоагуляция, вследствие активации обоих путей коагуляции, при ведущей роли ВНЕШНЕГО системное поражение эндотелия ”Протеолитический взрыв”вследствие активации 4 -х плазменных систем: свертывающей- сгустки¸ тромбы тромботический синдром фибринолитической) ПДФ геморрагический синдром калликреин-кининовой АД ¸ повышение сосудистой проницаемости Комплемента стимуляция всех звеньев гемостаза поступления клеточных протеаз Коагулопатия и эндотоксинемия Эндотоксикоз Цитокиновый «шторм» тромбоцитопения потребления с истощением про- и антикоагулянтов (I II V VIII XIII АТ III протеинов C S Увеличение. ПДФ Патологический фибринолиз Тромбо - геморрагический синдром
Патогенез гемостазиологических расстройств при ДВС Гиперкоагуляция, вследствие активации обоих путей коагуляции, при ведущей роли ВНЕШНЕГО системное поражение эндотелия ”Протеолитический взрыв”вследствие активации 4 -х плазменных систем: свертывающей- сгустки¸ тромбы тромботический синдром фибринолитической) ПДФ геморрагический синдром калликреин-кининовой АД ¸ повышение сосудистой проницаемости Комплемента стимуляция всех звеньев гемостаза поступления клеточных протеаз Коагулопатия и эндотоксинемия Эндотоксикоз Цитокиновый «шторм» тромбоцитопения потребления с истощением про- и антикоагулянтов (I II V VIII XIII АТ III протеинов C S Увеличение. ПДФ Патологический фибринолиз Тромбо - геморрагический синдром
 Патогенез ПОН при ДВС Блокада микроциркуляции микротромбами и сгустками Реологическая окклюзия капилляров ИШЕМИЯ тканей Гипоксия и деструкция клеток шоковых органов ДИСФУНКЦИЯ : ЦНС, ПОЧЕК, ЛЕГКИХ, ПЕЧЕНИ, СЕРДЦА надпочечниковая недостаточность Инфаркт миокардаа Тромбо - геморрагический синдром ОПН ГУС Гемокоагуляци онный ШОК полиорганная недостаточность (ПОН)
Патогенез ПОН при ДВС Блокада микроциркуляции микротромбами и сгустками Реологическая окклюзия капилляров ИШЕМИЯ тканей Гипоксия и деструкция клеток шоковых органов ДИСФУНКЦИЯ : ЦНС, ПОЧЕК, ЛЕГКИХ, ПЕЧЕНИ, СЕРДЦА надпочечниковая недостаточность Инфаркт миокардаа Тромбо - геморрагический синдром ОПН ГУС Гемокоагуляци онный ШОК полиорганная недостаточность (ПОН)
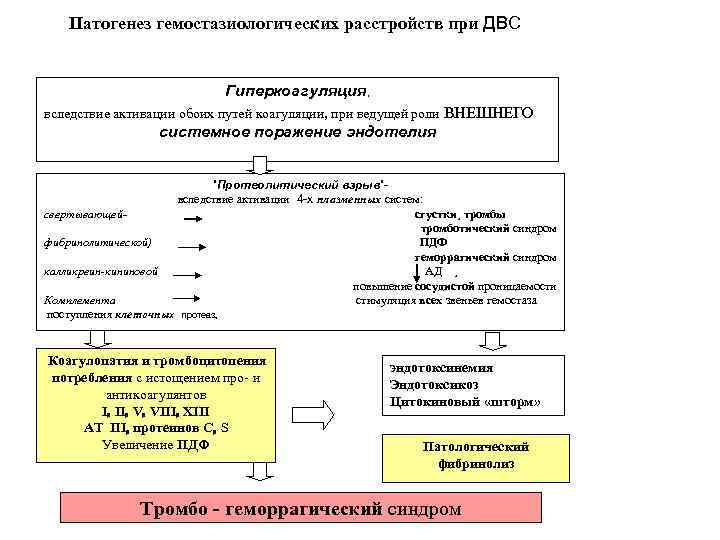 Патогенез гемостазиологических расстройств при ДВС Гиперкоагуляция, вследствие активации обоих путей коагуляции, при ведущей роли ВНЕШНЕГО системное поражение эндотелия ”Протеолитический взрыв”вследствие активации 4 -х плазменных систем: свертывающей- сгустки¸ тромбы тромботический синдром фибринолитической) ПДФ геморрагический синдром калликреин-кининовой АД ¸ повышение сосудистой проницаемости Комплемента стимуляция всех звеньев гемостаза поступления клеточных протеаз Коагулопатия и тромбоцитопения потребления с истощением про- и антикоагулянтов I II V VIII XIII АТ III протеинов C S Увеличение ПДФ эндотоксинемия Эндотоксикоз Цитокиновый «шторм» Патологический фибринолиз Тромбо - геморрагический синдром
Патогенез гемостазиологических расстройств при ДВС Гиперкоагуляция, вследствие активации обоих путей коагуляции, при ведущей роли ВНЕШНЕГО системное поражение эндотелия ”Протеолитический взрыв”вследствие активации 4 -х плазменных систем: свертывающей- сгустки¸ тромбы тромботический синдром фибринолитической) ПДФ геморрагический синдром калликреин-кининовой АД ¸ повышение сосудистой проницаемости Комплемента стимуляция всех звеньев гемостаза поступления клеточных протеаз Коагулопатия и тромбоцитопения потребления с истощением про- и антикоагулянтов I II V VIII XIII АТ III протеинов C S Увеличение ПДФ эндотоксинемия Эндотоксикоз Цитокиновый «шторм» Патологический фибринолиз Тромбо - геморрагический синдром
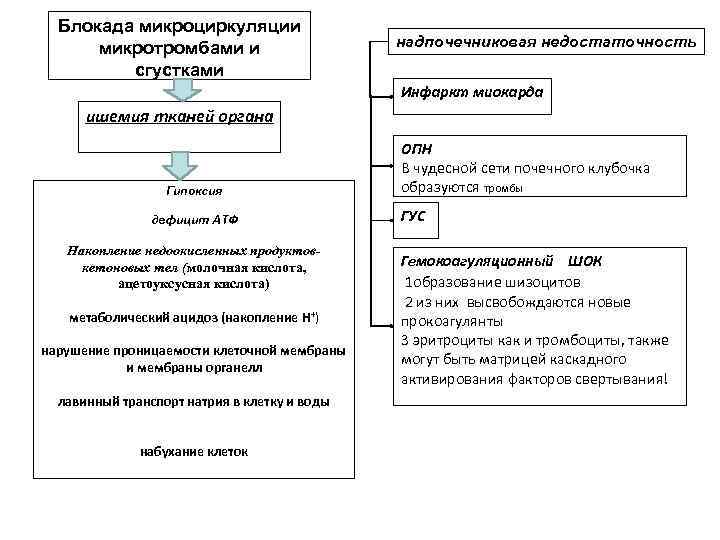 Блокада микроциркуляции микротромбами и сгустками надпочечниковая недостаточность Инфаркт миокарда ишемия тканей органа Гипоксия дефицит АТФ Накопление недоокисленных продуктовкетоновых тел (молочная кислота, ацетоуксусная кислота) метаболический ацидоз (накопление Н+) нарушение проницаемости клеточной мембраны и мембраны органелл лавинный транспорт натрия в клетку и воды набухание клеток ОПН В чудесной сети почечного клубочка образуются тромбы ГУС Гемокоагуляционный ШОК 1 образование шизоцитов 2 из них высвобождаются новые прокоагулянты 3 эритроциты как и тромбоциты, также могут быть матрицей каскадного активирования факторов свертывания!
Блокада микроциркуляции микротромбами и сгустками надпочечниковая недостаточность Инфаркт миокарда ишемия тканей органа Гипоксия дефицит АТФ Накопление недоокисленных продуктовкетоновых тел (молочная кислота, ацетоуксусная кислота) метаболический ацидоз (накопление Н+) нарушение проницаемости клеточной мембраны и мембраны органелл лавинный транспорт натрия в клетку и воды набухание клеток ОПН В чудесной сети почечного клубочка образуются тромбы ГУС Гемокоагуляционный ШОК 1 образование шизоцитов 2 из них высвобождаются новые прокоагулянты 3 эритроциты как и тромбоциты, также могут быть матрицей каскадного активирования факторов свертывания!
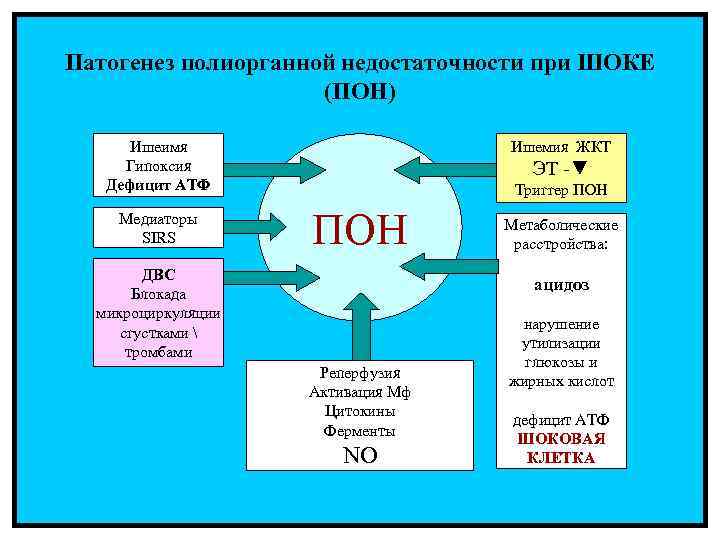 Патогенез полиорганной недостаточности при ШОКЕ (ПОН) Ишеимя Гипоксия Дефицит АТФ Медиаторы SIRS Ишемия ЖКТ ЭТ -▼ Триггер ПОН ДВС Блокада микроциркуляции сгустками тромбами Метаболические расстройства: ацидоз Реперфузия Активация Мф Цитокины Ферменты NO нарушение утилизации глюкозы и жирных кислот дефицит АТФ ШОКОВАЯ КЛЕТКА
Патогенез полиорганной недостаточности при ШОКЕ (ПОН) Ишеимя Гипоксия Дефицит АТФ Медиаторы SIRS Ишемия ЖКТ ЭТ -▼ Триггер ПОН ДВС Блокада микроциркуляции сгустками тромбами Метаболические расстройства: ацидоз Реперфузия Активация Мф Цитокины Ферменты NO нарушение утилизации глюкозы и жирных кислот дефицит АТФ ШОКОВАЯ КЛЕТКА
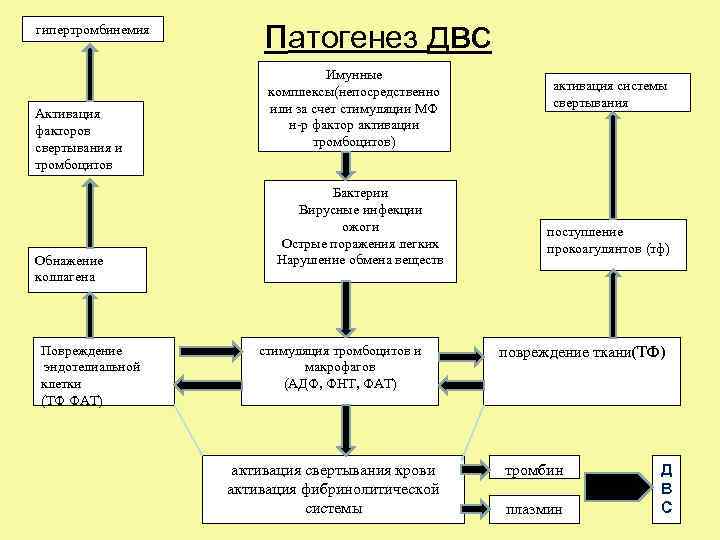 гипертромбинемия Активация факторов свертывания и тромбоцитов Обнажение коллагена Повреждение эндотелиальной клетки (ТФ ФАТ) патогенез двс Имунные комплексы(непосредственно или за счет стимуляции МФ н-р фактор активации тромбоцитов) Бактерии Вирусные инфекции ожоги Острые поражения легких Нарушение обмена веществ стимуляция тромбоцитов и макрофагов (АДФ, ФНТ, ФАТ) активация свертывания крови активация фибринолитической системы активация системы свертывания поступление прокоагулянтов (тф) повреждение ткани(ТФ) тромбин плазмин Д В С
гипертромбинемия Активация факторов свертывания и тромбоцитов Обнажение коллагена Повреждение эндотелиальной клетки (ТФ ФАТ) патогенез двс Имунные комплексы(непосредственно или за счет стимуляции МФ н-р фактор активации тромбоцитов) Бактерии Вирусные инфекции ожоги Острые поражения легких Нарушение обмена веществ стимуляция тромбоцитов и макрофагов (АДФ, ФНТ, ФАТ) активация свертывания крови активация фибринолитической системы активация системы свертывания поступление прокоагулянтов (тф) повреждение ткани(ТФ) тромбин плазмин Д В С
present5.com
ДВС синдром — это неспецифический патологический процесс, который соотносится с проникновением в ток крови активаторов свертывания крови. Помимо этого в зоне микроциркуляции начинает образовываться большое количество небольших кровяных сгустков и агрегатов клеток, провоцирующих блокаду микроциркуляции в органах.
Патогенез двс синдрома — сложный процесс, вызывающий большое количество затруднений при диагностике.
На первое место среди всех этиологических факторов ДВС синдрома ставятся общие вирусные и бактериальные инфекционные поражения, а также септические патологии. ДВС часто сопровождает сердечную недостаточность и гипертоническую болезнь, отморожения, ожоги, опухолевые образования, лейкозы, но не всегда он вовремя дает о себе знать, поэтому вызывает проблемы со стороны диагностики.
 Способствует развитию данной патологии экстракорпоральное кровообращение в таких аппаратах, как «искусственная почка» или «искусственное сердце», контактирование крови с протезами сердечных клапанов.
Способствует развитию данной патологии экстракорпоральное кровообращение в таких аппаратах, как «искусственная почка» или «искусственное сердце», контактирование крови с протезами сердечных клапанов.
ДВС синдром способен развиваться при повреждении стенок сосудов при поражении организма васкулитом, при отечности тканей и при недостаточности сердца. Помимо этого данное заболевание считается неотъемлемым компонентом шока независимо от его происхождения.
Причины двс синдрома разнообразны. Важную роль для его возникновения играют нарушения в микроциркуляции, которые не соотносятся с сосудистыми стенками: нарушение свойств текучести крови под влиянием повышения концентрации белка, увеличение концентрации эритроцитов в крови. Образование механических преград также провоцирует замедление кровообращения и активизирует процессы свертываемости крови.
Основная роль в патогенезе ДВС синдрома отводится формированию в крови факторов, которые активизируют агрегацию клеток и активизируют процесс свертывания крови. Таким образом, подобные вещества попадают в кровь в случае размозжения тканей, после операций разминания органов, при родах или при послеродовых манипуляциях, при гибели клеток.
Клинические проявления заболевания включают в себя геморрагические, тромботические и микроциркуляторные отклонения.
Хроническая форма имеет менее четкие симптомы. При этом в пораженных органах наблюдается явная дисфункция, также формируется тромбоз в магистральных венах.
В медицине ДВС разделяется на четыре основные фазы своего развития:
Проявления ДВС синдрома складываются из признаков первичной патологии организма, спровоцировавшей его возникновение, а также из лабораторных и клинических проявлений самого синдрома.
ДВС синдром с высокой вероятностью возникает при любых видах шоковых состояний. Сила проявления синдрома, как правило, соответствует серьезности и продолжительности полученного шокового состояния и силе характерных для данного состояния расстройств микроциркуляции.
К признакам собственно ДВС синдрома следует относить:
 Лечебная терапия ДВС синдрома может быть успешной только при условии организации правильного лечения первичной патологии, спровоцировавшей ДВС синдром. В связи с этим, невозможно добиться выздоровления без массивной антибиотической терапии, особенно при развитии сепсиса.
Лечебная терапия ДВС синдрома может быть успешной только при условии организации правильного лечения первичной патологии, спровоцировавшей ДВС синдром. В связи с этим, невозможно добиться выздоровления без массивной антибиотической терапии, особенно при развитии сепсиса.
Также лечение полностью зависит от стадии заболевания. Первоначально потребуется избавиться от причины, приведшей к его развитию. Если ярко выраженная причина не была обнаружена, то процесс лечения начинается с симптоматической терапии, которая предполагает проведение восстановления гемодинамики, дыхательной работы легких, микроциркуляции и коррекции нарушений метаболических процессов.
Самый безопасный и надежный способ проведения лечения ДВС синдрома — это лечебный плазмафорез. Эффект от данной процедуры объясняется блокированием активности системы мононуклеарных фагоцитов и последующим выведением из тока крови продуктов от фибринолиза и коагуляции, белков и других соединений, которые способствуют прогрессированию ДВС синдрома.
Лечением патологии после устранения запускающего механизма становится заместительная терапия, а также гепаринотерапия в небольших дозировках. Для остановки обширного образования тромбов гепарин применяется именно в маленьких дозах. Если при организации симптоматического лечения ДВС синдром продолжает свое развитие на протяжении последующих шести часов, то также показано лечение гепарином.
На первых этапах развития ДВС синдрома хороший эффект лечения дает терапия аденоблокаторами. Результат их использования основывается на улучшении процессов микроциркуляции, предотвращении формирования тромбов и снижении объединения тромбоцитов.
tvoelechenie.ru
1 ФАЗА – гипокоагуляции.
Ее биологический смысл заключается в образовании и накоплении активного тромбопластина, который представлен тремя фракциями:
активный кровяной тромбопластин - продукт лизиса форменных элементов крови
активный плазменный тромбопластин - продукт активации плазменных факторов
активный тканевой тромбопластин.
Развитию этой фазы ДВС-синдрома предшествуют следующие изменения в организме:
тяжелые нарушения микроциркуляции
повреждение эндотелия сосудов микроциркуляторного русла
нарушение реологических свойств крови.
Вне зависимости от причины, вызвавшей развитие ДВС-синдрома, в организме родильницы происходят следующие изменения:
спазм сосудов микроциркуляторного русла (кратковременный или длительный)
повреждение эндотелия сосудов микроциркуляторного русла
повышение проницаемости сосудистой стенки
феномен капиллярного просачивания
гиповолемия
увеличение вязкости крови
снижение скорости кровотока
фракционирование крови с краевым стоянием форменных элементов
увеличение объема медленноциркулирующих и нециркулирующих форменных элементов
10. развитие сладж-синдрома
11. разрушение, секвестрация форменных элементов (тромбоцитов, эритроцитов, лейкоцитов) с высвобождением кровяного тромбопластина.
развитие ацидоза в тканях
накопление кислых продуктов
накопление биологически активных веществ:
активация прокоагулянтного звена гемостаза – это 13 факторов свертывающей системы
запускается реакция ферментативного каскада
активируются плазменные факторы свертывания крови, при которой каждая активная форма предыдущего фактора активирует последующий, то есть является катализатором.
Ключевой реакцией является активация 12 фактора свертывающей системы крови – так называемого фактора Хагемана. Под его влиянием происходит образование акцелерина (это 5 активный фактор свертывающей системы крови – плазменный тромбопластин).
При эмболии околоплодными водами, разрыве матки и развитии матки Кювелера происходит выделение в общий кровоток активного тромбопластина. В фазу гипокоагуляции клинических проявлений ДВС-синдрома нет.
повышение уровня фибриногена более 4,5 г/л
увеличение количества тромбоцитов более 320 тысяч
повышение протромбинового индекса более 100%
увеличение индекса коагуляции более 1% - отношение протромбинового индекса к времени рекальцификации крови
повышение толерантности плазмы к гепарину
уменьшение времени рекальцификации крови менее 100 секунд
снижение времени свертывания крови менее 5 минут
снижение тромбинового времени менее 4 секунд.
Биологический смысл этой фазы ДВС-синдрома заключается в том, что в результате массивного внутрисосудистого свертывания в микроциркуляторном русле, в крови развивается состояние гипофибриногенемии. Это так называемая коагулопатия потребления.
образование тромбина:
под влиянием активного тромбопластина в присутствии ионов кальция, происходит образование тромбина из протромбина
образование фибрина:
тромбин вызывает расщепление фибриногена на фибриноген-мономер и фибриноген-пептид А и Б
фибрин-мономер в присутствии ионов кальция полимеризируется в фибриноген-S (это растворимый фибрин)
в присутствии 12 фактора свертывания крови (фактора Хагемана) происходит превращение фибриногена-S в нерастворимый фибриноген
нерастворимый фибриноген выпадает в сосудах микроциркуляторного русла в виде сгустков, вызывая их обструкцию
развивается циркуляторная и тканевая гипоксия
возникает функциональная полиорганная недостаточность
при дальнейшем прогрессировании развивается морфологическая, необратимая полиорганная недостаточность (происходит гибель клеток)
так как в крови используется фибриноген, то развивается гипофибриногенемия.
studfiles.net
ДВС-синдром возникает обычно в результате поступления в кровь или образования в ней веществ, инициирующих свертывание крови. Основополагающее событие в генезе острого ДВС-синдрома -
чрезмерная активация свертывающей системы крови с образованием избытка тромбина, сопровождающаяся падением уровня тромбоцитов и факторов свертывания крови. К этому синдрому чаще всего могут приводить следующие состояния:
1.
Повреждение тканей (массивный контакт крови с тканевым фактором):
• Механическая травма (краш-синдром,проникающие повреждения, напримерповреждения мозга).
• Термальные повреждения (ожоги, обморожения).
• Асфиксия и гипоксия.
• Оперативные вмешательства.
• Ишемия органов, инфаркты.

Рис. 144. ДВС-синдром - состояние, при котором развивается декомпенсация, динамическое равновесие не достигается из-за чрезмерной активации факторов, вызывающих гиперкоагуляцию
Патология гемостаза
• Жировая эмболия.
• Гиповолемический/геморрагический/анафилактический шок.
• Гипертермия.
2. Онкология (контакт с онкологическими про-коагулянтами, тканевым фактором, факторомнекроза опухоли, клеточными протеазами):
• Солидные опухоли.
• Лейкозы.
3. Инфекция (воздействие эндотоксинов, повреждение эндотелиальных клеток, активация тромбоцитов):
• Бактериальные инфекции, вызванные менингококками, Е. coli, Salmonella, Pseudo-monas, Haemophilus, Pneumococcus,Hemolytic streptococci, Staphylococcus.
• Вирусные инфекции, вызванные Dengue,Lassa, Ebola, Marburg, Hantaan, Rubella,Herpes и др.
• Протозойные - малярия.
• Другие - кандидозы, аспаргиллезы, кло-стридиозы, туберкулез.
• Токсический шок.
• Грамотрицательный сепсис.
4. Патология сосудов и циркуляторные нарушения(поражение эндотелия, активация тромбоцитов):
• Гигантская гемангиома, сосудистые опухоли.
• Аневризма аорты.
• Хирургические вмешательства на сосудах, внутрисосудистые манипуляции.
• Опухоли сердца.
• Операции шунтирования сосудов сердца.
• Острый инфаркт миокарда.
• Васкулиты.
• Эмболия легочной артерии.
5. Иммунологические нарушения (активациякомплемента, экспозиция тканевого фактора):
• Анафилактические реакции.
• Аллергические реакции.
• Острые гемолитические посттрансфузи-онные реакции.
• Гепарин-индуцированная тромбоцито-пения.
• Реакция отторжения трансплантата.
• Болезнь Кавасаки.
6. Прямая активация ферментов:
• Панкреатит.
• Укусы ядовитых змей.
7. Другие расстройства:
• Фульминантный некроз печени.
• Синдром Рейе.
• Цирроз печени.
• Респираторный дистресс-синдром увзрослых.
• Инфузия концентратов протромбиново-го комплекса.
• Гемолитико-уремический синдром.
• Воспалительные заболевания кишечника,перитонит.
• Саркоидоз, амилоидоз.
• Геморрагический шок.
• Гомозиготный дефицит протеинов С и S.
8. Осложнения беременности:
• Преждевременная отслойка плаценты.
• Эмболия амниотическими водами.
• Эклампсия и преэклампсия.
• Индуцированные аборты.
• Внутриутробная гибель плода или незаконченный аборт.
• Сросшаяся плацента.
• Разрыв матки.
• Хроническая трубная беременность.
• Дегенеративная фибромиома.
• Внутриутробная гибель одного из однояйцевых близнецов.
9. ДВС у новорожденных:
• Инфекции.
• Асфиксия в родах.
• Болезнь гиалиновых мембран.
• Аспирационный синдром, апноэ, ателектаз, пневмония.
• Легочное кровотечение.
• Переохлаждение.
• Глубокая недоношенность.
• Тромбозы крупных сосудов.
• Фульминантная пурпура.
• Некротизирующий энтероколит.
• Новообразования у плода и лейкозы.
• Повреждение головного мозга (некрозыи кровоизлияния).
• Фетальный эритробластоз.
• Поражение печени.
• Врожденное нарушение толерантности кфруктозе.
Основные патогенетические механизмы запуска ДВС:
• Нарушение или повреждение эндотелия, сопровождающееся высвобождением прокоагу-
Патология гемостаза
лянтов и контактом крови с тканевым фактором.
• Активация моноцитов с экспрессией тканевого фактора и прокоагулянтов моноцитов.Именно чрезмерная активация и дегрануля-ция моноцитов-макрофагов, обладающихполноценным кровяным тромбопластином,часто рассматривается как центральное звено ДВС-синдрома при сепсисе.
• Контакт с тканевым фактором клеток злокачественных опухолей. ДВС особенно часто возникает при аденокарциноме поджелудочной и предстательной желез, продуцирующей муцин, при остром промиелоцитар-ном лейкозе, при котором гипергранулярные лейкозные клетки высвобождают изгранул материал, подобный тканевому фактору.
• Массивное поступление в кровь физиологических прокоагулянтов при различных повреждениях, массивных травмах, эмболии идр. Травмы головы с нарушением гематоэн-цефалического барьера и контактом крови стканью мозга - мощный источник тканевоготромбопластина. Осложнения беременности,при которых материал, обладающий активностью тканевого фактора, попадает из полости матки в кровь матери (преждевременная отслойка плаценты, аборт, задержка мертворожденного плода или эмболия околоплодной жидкостью).
• Шок с выпадением функции органов и развитием полиорганной недостаточности.
• Введение факторов протромбинового комплекса, особенно активированных (переливание несовместимой крови).
• Массивное поступление в кровь бактериальных прокоагулянтов. В капсиде бактерийприсутствует большое количество липополи-сахаридов (эндотоксин, рис. 145), способныхрезко активировать моноциты-макрофагисистемы циркуляции.
• Прямая активация ферментами змеиныхядов.
Ведущую роль в запуске патологических процессов при ДВС, как правило, играет внешний путь активации протромбина. Активизация контактных факторов при ДВС-синдроме в первую очередь приводит к гипотонии и вазодилатации.

Рис. 145. Эндотоксинкапсида бактерий. Особенно его много у грамотрицательных бактерий. Эндотоксин вызывает массивную активацию с дегрануляцией моноцитов-макрофагов и освобождение в кровь большого количества кровяного тромбопластина, который индуцирует гиперкоагуляцию и развитие ДВС-синдрома
Еще одним звеном развития патологического свертывания крови и особенно синдрома потребления является повреждение тромбоцитов и эритроцитов. Кислые фосфолипиды, в норме находящиеся на внутренней поверхности клеточной мембраны, являются важным фактором активации процессов свертывания крови. Их появление в циркулирующей крови в большом количестве приводит к значительному усилению процесса свертывания крови и потреблению прокоагулянтов. Возможно, что активация системы комплемента также усиливает процесс потребления, но более вероятно, что это лишь два параллельных процесса.
Имеются данные, что у пациентов с коагуло-патией потребления снижена функция тканевых макрофагов и содержание фибронектина. Это приводит к снижению активности удаления макрофагами ретикулоэндотелиальной системы микроагрегатов фибрина, обломков коллагена и, возможно, бактерий и продуктов их жизнедеятельности.
Виды ДВС-синдрома
Лабораторные показатели, характеризующие состояние гиперкоагуляции и внутрисосудисто-го свертывания, меняются в зависимости от тече-
Патология гемостаза
ния и стадии процесса. По течению ДВС-синдром подразделяют на:
• Острый, включая молниеносную (катастрофическую) форму. Острый ДВС-синдром проявляется комплексом аномалий, включающим нарушение микроциркуляции, повреждение сосудистой стенки, тромбоцитопениюи тромбоцитопатию, анизоцитоз и гемолизэритроцитов, нейтрофильную реакцию, гиперкоагуляцию и геморрагический синдромна фоне коагулопатии и тромбоцитопатиипотребления, нарушения в системах фибри-нолиза, антикоагулянтов, калликреин-кини-новой и других протеолитических систем.Фазы острого ДВС-синдрома:
1) гиперкоагуляция и гиперагрегация;
2) коагулопатия и тромбоцитопатия потребления с активацией фибринолитичес-кой системы;
3) генерализация фибринолиза;
4) восстановление.
• Подострый с длительным периодом гиперкоагуляции и/или гиперагрегации тромбоцитов.Подострый ДВС-синдром, характеризующийся вялотекущим, скорее хроническим течением, лабораторно проявляется тромбоци-топенией, нормальным или несколько удлиненным ПВ, укорочением АЧТВ, нормальным или несколько сниженным фибриногеном и повышением уровня в плазме продуктов деградации фибрина (ПДФ). Следует отметить, что фибриноген, как острофазныйбелок, при инфекционных и травматическихформах ДВС может быть повышенным. Этосостояние может приводить к тромбоэмболи-ческим осложнениям, в том числе к тромбозам вен, артериальной тромбоэмболии. Кровоточивость встречается нечасто.
• Хронический. Для хронической формы ДВС-синдрома характерно постоянное, но менеесильное активирующее воздействие на систему гемостаза. Это обуславливает малую скорость генерации тромбина, однако достаточную для развития микроциркуляторных нарушений. Хроническая форма ДВС-синдрома наблюдается при хронических заболеваниях легких, почек, атеросклерозе, сахарномдиабете, артериальной гипертензии и другихзаболеваниях.
poisk-ru.ru
ДВС-синдром возникает обычно в результате поступления в кровь или образования в ней веществ, инициирующих свертывание крови. Основополагающее событие в генезе острого ДВС-синдрома -
чрезмерная активация свертывающей системы крови с образованием избытка тромбина, сопровождающаяся падением уровня тромбоцитов и факторов свертывания крови. К этому синдрому чаще всего могут приводить следующие состояния:
1.
Повреждение тканей (массивный контакт крови с тканевым фактором):
• Механическая травма (краш-синдром,проникающие повреждения, напримерповреждения мозга).
• Термальные повреждения (ожоги, обморожения).
• Асфиксия и гипоксия.
• Оперативные вмешательства.
• Ишемия органов, инфаркты.

Рис. 144. ДВС-синдром - состояние, при котором развивается декомпенсация, динамическое равновесие не достигается из-за чрезмерной активации факторов, вызывающих гиперкоагуляцию
Патология гемостаза
• Жировая эмболия.
• Гиповолемический/геморрагический/анафилактический шок.
• Гипертермия.
2. Онкология (контакт с онкологическими про-коагулянтами, тканевым фактором, факторомнекроза опухоли, клеточными протеазами):
• Солидные опухоли.
• Лейкозы.
3. Инфекция (воздействие эндотоксинов, повреждение эндотелиальных клеток, активация тромбоцитов):
• Бактериальные инфекции, вызванные менингококками, Е. coli, Salmonella, Pseudo-monas, Haemophilus, Pneumococcus,Hemolytic streptococci, Staphylococcus.
• Вирусные инфекции, вызванные Dengue,Lassa, Ebola, Marburg, Hantaan, Rubella,Herpes и др.
• Протозойные - малярия.
• Другие - кандидозы, аспаргиллезы, кло-стридиозы, туберкулез.
• Токсический шок.
• Грамотрицательный сепсис.
4. Патология сосудов и циркуляторные нарушения(поражение эндотелия, активация тромбоцитов):
• Гигантская гемангиома, сосудистые опухоли.
• Аневризма аорты.
• Хирургические вмешательства на сосудах, внутрисосудистые манипуляции.
• Опухоли сердца.
• Операции шунтирования сосудов сердца.
• Острый инфаркт миокарда.
• Васкулиты.
• Эмболия легочной артерии.
5. Иммунологические нарушения (активациякомплемента, экспозиция тканевого фактора):
• Анафилактические реакции.
• Аллергические реакции.
• Острые гемолитические посттрансфузи-онные реакции.
• Гепарин-индуцированная тромбоцито-пения.
• Реакция отторжения трансплантата.
• Болезнь Кавасаки.
6. Прямая активация ферментов:
• Панкреатит.
• Укусы ядовитых змей.
7. Другие расстройства:
• Фульминантный некроз печени.
• Синдром Рейе.
• Цирроз печени.
• Респираторный дистресс-синдром увзрослых.
• Инфузия концентратов протромбиново-го комплекса.
• Гемолитико-уремический синдром.
• Воспалительные заболевания кишечника,перитонит.
• Саркоидоз, амилоидоз.
• Геморрагический шок.
• Гомозиготный дефицит протеинов С и S.
8. Осложнения беременности:
• Преждевременная отслойка плаценты.
• Эмболия амниотическими водами.
• Эклампсия и преэклампсия.
• Индуцированные аборты.
• Внутриутробная гибель плода или незаконченный аборт.
• Сросшаяся плацента.
• Разрыв матки.
• Хроническая трубная беременность.
• Дегенеративная фибромиома.
• Внутриутробная гибель одного из однояйцевых близнецов.
9. ДВС у новорожденных:
• Инфекции.
• Асфиксия в родах.
• Болезнь гиалиновых мембран.
• Аспирационный синдром, апноэ, ателектаз, пневмония.
• Легочное кровотечение.
• Переохлаждение.
• Глубокая недоношенность.
• Тромбозы крупных сосудов.
• Фульминантная пурпура.
• Некротизирующий энтероколит.
• Новообразования у плода и лейкозы.
• Повреждение головного мозга (некрозыи кровоизлияния).
• Фетальный эритробластоз.
• Поражение печени.
• Врожденное нарушение толерантности кфруктозе.
Основные патогенетические механизмы запуска ДВС:
• Нарушение или повреждение эндотелия, сопровождающееся высвобождением прокоагу-
Патология гемостаза
лянтов и контактом крови с тканевым фактором.
• Активация моноцитов с экспрессией тканевого фактора и прокоагулянтов моноцитов.Именно чрезмерная активация и дегрануля-ция моноцитов-макрофагов, обладающихполноценным кровяным тромбопластином,часто рассматривается как центральное звено ДВС-синдрома при сепсисе.
• Контакт с тканевым фактором клеток злокачественных опухолей. ДВС особенно часто возникает при аденокарциноме поджелудочной и предстательной желез, продуцирующей муцин, при остром промиелоцитар-ном лейкозе, при котором гипергранулярные лейкозные клетки высвобождают изгранул материал, подобный тканевому фактору.
• Массивное поступление в кровь физиологических прокоагулянтов при различных повреждениях, массивных травмах, эмболии идр. Травмы головы с нарушением гематоэн-цефалического барьера и контактом крови стканью мозга - мощный источник тканевоготромбопластина. Осложнения беременности,при которых материал, обладающий активностью тканевого фактора, попадает из полости матки в кровь матери (преждевременная отслойка плаценты, аборт, задержка мертворожденного плода или эмболия околоплодной жидкостью).
• Шок с выпадением функции органов и развитием полиорганной недостаточности.
• Введение факторов протромбинового комплекса, особенно активированных (переливание несовместимой крови).
• Массивное поступление в кровь бактериальных прокоагулянтов. В капсиде бактерийприсутствует большое количество липополи-сахаридов (эндотоксин, рис. 145), способныхрезко активировать моноциты-макрофагисистемы циркуляции.
• Прямая активация ферментами змеиныхядов.
Ведущую роль в запуске патологических процессов при ДВС, как правило, играет внешний путь активации протромбина. Активизация контактных факторов при ДВС-синдроме в первую очередь приводит к гипотонии и вазодилатации.

Рис. 145. Эндотоксинкапсида бактерий. Особенно его много у грамотрицательных бактерий. Эндотоксин вызывает массивную активацию с дегрануляцией моноцитов-макрофагов и освобождение в кровь большого количества кровяного тромбопластина, который индуцирует гиперкоагуляцию и развитие ДВС-синдрома
Еще одним звеном развития патологического свертывания крови и особенно синдрома потребления является повреждение тромбоцитов и эритроцитов. Кислые фосфолипиды, в норме находящиеся на внутренней поверхности клеточной мембраны, являются важным фактором активации процессов свертывания крови. Их появление в циркулирующей крови в большом количестве приводит к значительному усилению процесса свертывания крови и потреблению прокоагулянтов. Возможно, что активация системы комплемента также усиливает процесс потребления, но более вероятно, что это лишь два параллельных процесса.
Имеются данные, что у пациентов с коагуло-патией потребления снижена функция тканевых макрофагов и содержание фибронектина. Это приводит к снижению активности удаления макрофагами ретикулоэндотелиальной системы микроагрегатов фибрина, обломков коллагена и, возможно, бактерий и продуктов их жизнедеятельности.
Виды ДВС-синдрома
Лабораторные показатели, характеризующие состояние гиперкоагуляции и внутрисосудисто-го свертывания, меняются в зависимости от тече-
Патология гемостаза
ния и стадии процесса. По течению ДВС-синдром подразделяют на:
• Острый, включая молниеносную (катастрофическую) форму. Острый ДВС-синдром проявляется комплексом аномалий, включающим нарушение микроциркуляции, повреждение сосудистой стенки, тромбоцитопениюи тромбоцитопатию, анизоцитоз и гемолизэритроцитов, нейтрофильную реакцию, гиперкоагуляцию и геморрагический синдромна фоне коагулопатии и тромбоцитопатиипотребления, нарушения в системах фибри-нолиза, антикоагулянтов, калликреин-кини-новой и других протеолитических систем.Фазы острого ДВС-синдрома:
1) гиперкоагуляция и гиперагрегация;
2) коагулопатия и тромбоцитопатия потребления с активацией фибринолитичес-кой системы;
3) генерализация фибринолиза;
4) восстановление.
• Подострый с длительным периодом гиперкоагуляции и/или гиперагрегации тромбоцитов.Подострый ДВС-синдром, характеризующийся вялотекущим, скорее хроническим течением, лабораторно проявляется тромбоци-топенией, нормальным или несколько удлиненным ПВ, укорочением АЧТВ, нормальным или несколько сниженным фибриногеном и повышением уровня в плазме продуктов деградации фибрина (ПДФ). Следует отметить, что фибриноген, как острофазныйбелок, при инфекционных и травматическихформах ДВС может быть повышенным. Этосостояние может приводить к тромбоэмболи-ческим осложнениям, в том числе к тромбозам вен, артериальной тромбоэмболии. Кровоточивость встречается нечасто.
• Хронический. Для хронической формы ДВС-синдрома характерно постоянное, но менеесильное активирующее воздействие на систему гемостаза. Это обуславливает малую скорость генерации тромбина, однако достаточную для развития микроциркуляторных нарушений. Хроническая форма ДВС-синдрома наблюдается при хронических заболеваниях легких, почек, атеросклерозе, сахарномдиабете, артериальной гипертензии и другихзаболеваниях.
studopedya.ru
При рассмотрении патогенеза необходимо учитывать определенные физиологические изменения, происходящие в организме беременной. Исходную физиологическую гиперкоагуляцию крови, достигающую максимального развития к концу III семестра и направленную на обеспечение маточного гемостаза в послеродовом периоде. Развитие гиперволемии и одновременно с этим снижение скорости кровотока. Все эти механизмы носят адаптационно-защитный характер, но полноценно функционируют лишь у здоровых беременных. В случае же патологии, приводящей к активации системы гемостаза, они теряют свою защитную функцию и способствуют усугублению состояния.
В ответ на кровотечение система гемостаза реагирует на двух уровнях: а) локально — путем активации внутреннего пути (через фактор контакта) свертывания крови, что приводит к образованию тромбов на плацентарной площадке; б) глобально — активация внутрисосудистого свертывания крови по внешнему пути на фоне уже имеющейся гиперкоагуляционной настроенности организма. Чаще всего эти механизмы в сочетании с лечебными мероприятиями приводят к остановке кровотечения. Но при наличии патологических процессов (гестоз и др.), когда резервные возможности ограничены,, кровотечение начинает усиливаться и приобретает массивный характер, совсем не обязательно связанный с первичной гипотонией мио-метрия. Однако следует отметить, что при развитии внутрисосудистого свертывания крови и формировании «шоковой матки», ишемия и метаболические сдвиги приводят к ее релаксации и отсутствию чувствительности к утеротоническим веществам.
Для облегчения восприятия условно выделяют три фазы острой формы синдрома ДВС.
1. Фаза гиперкоагуляции — резкое возрастаниие коагуляционного потенциала крови за счет активации факторов свертывания по внутреннему и внешнему пути. Образование агрегатов, тромбоцитов, блокада микроциркуляции жизненно важных органов, что приводит к артериоло-венулезному пунктированию, формированию феномена сладжирования. Естественно, что эти процессы способствуют гипоксии, ацидозу, что само по себе активирует процесс свертывания. Как правило, в случае неадекватной терапии эта фаза при сопоставлении с фазами развития геморрагического шока соответствует вазоконстрикции или адренергической фазе, то есть развивается на фоне массивного выброса в крови гормонов и катехоламинов, что также способствует гиперкоагуляции и гиперагрегации тромбоцитов. К сожалению, эта мобилизационная фаза протекает в течение нескольких (7—20) минут и заканчивается массивным внутрисосудистым свертыванием, приводящим к тяжелому гемо-коагуляционному шоку. Клинически эта фаза проявляется продолжающимся, но не усиливающимся кровотечением, лабораторно — реальной гиперкоагуляцией. Параллельно с активацией свертывания крови происходит и активация фибринолиза.
2. Коагулопатия потребления. Суть этой фазы заключается в том, что в результате массивной гемокоагуляции — потребления факторов свертывания и тромбоцитов, истощения антикоагу-ляционных механизмов гемостаза — кровь теряет свою способность к свертыванию. Сгустки практически не образуются или становятся рыхлыми. Параллельно с этим развивается активный протеолиз, в результате которого в организме происходит расщепление белковых структур, из них в первую очередь лизируются фибрин, фибриноген и другие факторы свертывания. Кроме того, расщеплению подвергаются и белки, поддерживающие обменные процессы, причем тканевые киназы (тромбопластин) сами также являются стимуляторами протеолиза. В крови появляется и интенсивно нарастает концентрация патологических ингибиторов и продуктов свертывания (ПДФФ, РКМФ, антиплазминов). Эта фаза при отсутствии соответствующей терапии обычно соответствует атонической фазе геморрагического шока. Клинически на этом этапе на первое место выходят проявления шока и геморрагического диатеза. Лабораторно — реальная гипокоагуляция, активация фибринолиза, потенциальная гиперкоагуляция, положительная проба переноса по К. Раби. Потенциальная гиперкоагуляция объясняется тем, что в организме сохраняется общий гиперкоагуляционный настрой за счет ненарушенного тромбинообразования, но реализовать коагуляционную активность нечем, так как нет субстрата, поэтому при введении извне факторов свертывания происходит их быстрое потребление, то есть возникает парадокс, названный К. Раби «подбрасыванием дроз в костер». В целом указанные процессы удачно иллюстрирует рис, 6 (Серов В. Н., Макацария А. Д., 1987).

Рис. 6. Патогенез кровоточивости при острой форме синдрома ДВС (Серов В. Н., Макацария А. Д., 1987).
3. Третья фаза — исходы и остаточные явления. Если в результате правильной и рациональной терапии удается остановить кровотечение, что бывает далеко не всегда, включая хирургический путь, то это еще не значит, что опасность миновала. Не следует забывать, что остановив кровотечение, мы не ликвидировали ДВС-синдром и его последствия обязательно появятся. В этом случае на первое место выступает мультиорганная патология, связанная с нарушением функционирования жизненно важных органов, возникающая как следствие нарушения микроциркуляции в них. Иначе это состояние называют формированием шоковых органов. К сожалению, часто этот процесс заканчивается гибелью больной в результате нарастающей почечной или печеночной недостаточности, нарушений деятельности сердечно-сосудистой и дыхательной систем. Лабораторно этот период характеризуется нарастанием гиперкоагуляции в первые 3 — 6 сут, то есть происходит формирование тромбофилического состояния и синдром ДВС начинает носить хронический характер. В дальнейшем эти больные попадают в группу риска развития тромбоэмболии легочной артерии, как правило, на б—15-е сут, а лишь затем начинается процесс постепенной нормализации гемостазиологических параметров, который затягивается иногда на месяцы. Динамика показателей тромбоэластограммы при различных фазах ДВС-синдрома показана на рис. 7.

Рис. 7. Данные тромбоэластографии при синдроме ДВС:
а — острая форма, хронометрическая и структурная гипокоагуляция; б — хроническая форма, хронометрическая и структурная гиперкоагуляция; 1 — плазма донора, 2 — смесь плазмы донора и больного.
Если суммировать сказанное, то можно отметить, что в основе развития ДВС-синдрома лежит образование порочных кругов, разорвать которые очень трудно, а зачастую невозможно. Кроме послеродовых кровотечений острая форма ДВС характерна для таких тяжелых акушерских состояний, как отслойка плаценты, эмболия околоплодными водами.
В заключение необходимо еще раз отметить, что выделение фаз ДВС-синдрома является условным и механистическим. Необходимо уяснить, что все процессы, протекающие в организме, тесно взаимосвязаны и в результате правильного лечения или реализации защитно-компенсаторных возможностей этот процесс может оборваться на любом этапе.
Другой, наиболее часто встречающейся, формой ДВС-синдрома является хроническая длительно текущая, компенсированная, а иногда и суперкомпенсированная форма. Она развивается при многих патологических состояниях, о которых мы уже говорили. Для этой формы характерны тромботические осложнения в сочетании с симптомами ишемического поражения органов и тканей. Диагностика хронической формы представляет большие трудности, так как
у таких больных обнаруживается нормальное или даже повышенное содержание свертывающих факторов, что обусловлено превышением их продукции над потреблением. Наиболее достоверным тестом в этой ситуации наряду с хронометрической и структурной гиперкоагуляцией служит выявление у больных повышенной активности тромбина. Поскольку активность тромбина нельзя измерить прямым путем, в плазме определяют содержание продуктов его протеолитического действия — фибринмономеров (РКМФ), которые обнаруживаются при добавлении к плазме крови этанола или протамин-сульфата. Кроме того, можно обнаружить большие концентрации продуктов деградации фибрина и фибриногена (ПДФФ), которые являются практически единственными лабораторными свидетелями внутрисосудистого свертывания крови. Вместе с тем, соответствующие изменения возникают в тромбоцитарном звене, и в звене ингибиторов свертывания крови и фибринолиза, о чем свидетельствуют гпперагрегация и гиперадгезия тромбоцитов, а также снижение активности антитромбина III.
Очень информативный, но трудоемкий способ диагностики хронической формы — бульбарная микроскопия, так как глазное дно, единственное место, где можно прижизненно наблюдать за состоянием микроциркуляции. Особенностью формирования хронической формы является длительное существование реальной гиперкоагуляции, которая может продолжаться недели, месяцы и годы, не подвергаясь существенному изменению и не переходя границу потребления, хотя это состояние можно расценить как тромбофилическое. Однако в случае каких-либо провоцирующих моментов, какими являются роды, операция, утяжеление гестоза, усиление декомпенсации соматических заболеваний, может наступить реализация этого напряженного состояния в виде тромбозов, эмболии или кровотечений. Интересно, что у женщин, страдающих хронической формой ДВС, во время беременности аналогичные изменения происходят у плода и новорожденного. Велика роль этой формы в формировании плацентарной недостаточности, которой предшествует межворсинчатый тромбоз, в значительной степени снижающий перфузию плаценты.
Промежуточное положение между хроническим и острым занимает подострое течение ДВС-синдрома. Оно характерно для тяжелых форм гестозов, начиная с преэклампсии, септического шока, длительного нахождения мертвого плода в матке и для больных с искусственными клапанами сердца. С точки зрения клиники, для подострого течения характерны умеренные геморрагические проявления, подкожные и внутрикожные гематомы, подслизистые кровоизлияния, нередко в сочетании с призаками мультиорганной патологии. Чаще подострая форма развивается из хронической, усугубляя течение последней. Патогенетически она соответствует началу второй фазы синдрома ДВС, то есть коагулопатии потребления, и при определенных условиях может перейти в острую форму. В" качестве примера можно привести следующую модель, приведенную на рис- 8.
Токсикоз второй половины беременности приводит к формированию хронической формы ДВС-синдрома, отсутствие адекватной терапии способствует его прогрессированию до преэклампсии и эклампсии, на фоне которых развивается подострая форма. При попытке родоразрешения возникает кровотечение, которое приводит к острой форме ДВС и нередко заканчивается смертью. Следовательно, течение подострой формы неблагоприятно, так как это уже декомпенсированная форма. Лабораторная диагностика затруднена в связи с ее пограничным состоянием и характеризуется сочетанием признаков реальной гипокоагуляции на фоне умеренного или значительного уменьшения количества тромбоцитов и потенциальной гиперкоагуляции.
В целом же выбор тестов и логика диагностического процесса при нарушениях в системе гемостаза должны быть обусловлены целью исследования, анализом анемнеза и клинической ситуации. Это позволит предупредить поступление запоздалой и трудноинтерпре-тируемой информации. Зачастую правильный патогенетически обоснованный подход к оценке клинического состояния больной позволяет заменить результаты лабораторного исследования. Несмотря на обширные диагностические возможности, основными скрининговыми исследованиями в гемостазиологии остаются время свертывания крови по Ли — Уайту, тромбоэластография цельной крови или плазмы, этаноловый и протаминсульфатный тесты.

Рис. 8. Патогенез развития гемостазиологических нарушений при гестозах.
Актуальные вопросы акушерской патологии. Сидорова И. С, Шевченко Т. К., 1991г.
extremed.ru
| АрхеологияАрхитектураАстрономияАудитБиологияБотаникаБухгалтерский учётВойное делоГенетикаГеографияГеологияДизайнИскусствоИсторияКиноКулинарияКультураЛитератураМатематикаМедицинаМеталлургияМифологияМузыкаПсихологияРелигияСпортСтроительствоТехникаТранспортТуризмУсадьбаФизикаФотографияХимияЭкологияЭлектричествоЭлектроникаЭнергетика | Причины ДВС-синдрома . 1. Массивное поступление в кровь тромбопластина А. тканевого, что наблюдается при заболеваниях и состояниях, сопровождающихся значительным повреждением тканей: • при операциях на органах, богатых тромбопластином (матка, легкие, предстательная железа), • при тяжелой механической травме, электротравме, • при краш-синдроме, • при метастазировании опухолей Б. клеточного (эритроцитарного, тромбоцитарного, лейкоцитарного) • при лейкозах, • при гемолитических анемиях. • при переливании несовместимой крови, при переливании большого количества одногруппной крови (синдром гомологичной крови), • при повреждении эритроцитов в аппарате искусственного кровообращения, • при отравлении гемолитическими ядами. 2. Большое значение играет генерализованное повреждение эндотелия сосудов • при поступлении в кровь эндотоксинов грамотрицательных бактерий, менингококков, стрептококков, стафилококков, • при вирусных и грибковых инфекциях, • при иммунокомплексном повреждении сосудов). Патогенез ДВС-синдрома . Патогенез ДВС-синдрома различен, поэтому принято выделять: 1. ДВС с преобладанием пркоагулянтного звена гемостаза. 2. ДВС с преобладанием сосудисто-тромбоцитарного звена гемостаза . 3. ДВС с одинаковой активностью и прокоагулянтного и сосудисто- тромбоцитарного звеньев гемостаза. ДВС с преобладанием пркоагулянтного звена гемостаза развивается вследствие массивного поступления в кровоток прокоагулянтов. В клинике – это попадание в кровеносное русло тробопластических веществ при преждевременной отслойке плаценты, внутриутробной гибели плода, эмболии околоплодными водами, метастазирующем раке, внутрисосудистом гемолизе, обширных травмах. При поступлении тромбопластина происходит активация прежде всего внешняя система свертывания крови, что приводит к усиленному тромбогенезу. ДВС с преобладанием сосудисто-тромбоцитарного звена гемостаза – закономерный итог генерализованного поражения стенок сосудов и/или первичного воздействия на тромбоциты. Он встречается при различных инфекционных и аутоиммунных болезнях, реакции отторжения трансплантанта. При инфекционных заболеваниях внутрисосудистое свертывание возникает под воздействием эндотоксинов, комплексов антиген-антитело, а также в результате непосредственного повреждения эндотелия сосудов инфекционными агентами. При этом обнажаются субэндотелиальные структуры, которые активируют тромбоциты и внутреннюю систему свертывания крови через контактный фактор XII (фактор Хагемана). ДВС с одинаковой активностью и прокоагулянтного и сосудисто- тромбоцитарного звеньев гемостаза (форма смешанного патогенеза) сопровождает экстракорпоральное кровообращение, ожоги, острый лейкоз, шок.
СТАДИИ ДВС-СИНДРОМАВ развитии ДВС-синдрома различают четыре стадии, каждая из которых имеет свою особую клинико-лабораторную и морфологическую характеристику.Стадия I — гиперкоагуляция и внутрисосудистая агрегация клеток, активация других плазменных ферментных систем (например, калликреин-кининовой или системы комплемента) с развитием свертывания крови и формированием блокады микроциркуляторного русла в органах. Морфологически эта стадия характеризуется множественными микротромбами различного строения. Вариант окклюзии микроциркуляторного русла и распределение ее в органах зависят, очевидно, от этиологии, условий развития ДВС-синдрома (скорости возникновения и длительности процесса). Клинически I стадия проявляется развитием шока (при замедленном течении или умеренной тромбопластинемии часто не диагностируется).СтадияII— коагулопатия потребления. Для нее характерны уменьшение числа тромбоцитов вследствие их агрегации, снижение содержания фибриногена, использованного на образование фибрина, расход других плазменных факторов системы регуляции агрегатного состояния крови. Эта стадия возникает на высоте гиперкоагуляции и прогрессирует до выраженной гипокоагуляции, которая проявляется кровотечениями и/или геморрагическим диатезом. Следует помнить, что эта стадия является следствием как использования факторов свертывания для образования микротромбов, так и удаления их из кровотока клетками, способными к фагоцитозу. Результаты проведенных экспериментальных исследований на ультраструктурном уровне свидетельствуют, что уже на самых ранних этапах мелкие свертки фагоцитируются клетками эндотелия сосудов и лейкоцитами. Основную роль в процессе ликвидации последствий активации системы свертывания крови играют печень и селезенка, что морфологически проявляется наличием тяжей и нитей фибрина в их синусоидах. При умеренной тромбопластинемии внутрисосудистые образования могут полностью удаляться из кровотока, и лишь наличие фибрина в фагоцитах свидетельствует о ДВС.СтадияIII— активация фибринолиза — обеспечивает полноценное восстановление проходимости сосудов микроциркуляторного русла путем лизиса микротромбов. Однако нередко активация фибринолиза принимает генерализованный характер, в результате чего лизируются не только микросвертки фибрина, но и повреждаются циркулирующие в крови факторы свертывания и фибриноген. Диагностировать морфологически III стадию довольно трудно. Высокий фибринолиз при ДВС-синдроме обусловлен появлением в крови активной протеазы — плазмина, который расщепляет фибриноген и фибрин до ранних продуктов деградации — фрагментов X и Y с высокой молекулярной массой, а затем поздних — фрагментов D и Е с меньшей молекулярной массой. Мономер фибрина легко образует растворимые комплексы как с фибриногеном, так и с продуктами распада фибриногена, теряя при этом способность полимеризоваться. Наличие растворимых комплексов мономера фибрина с продуктами распада фибриногена расценивается как свидетельство внутрисосудистого свертывания и вторичного фибринолиза. Важным светооптическим признаком этой стадии некоторые считают наличие большого количества "гиалиновых" микротромбов. Они образуются в условиях циркуляции большого количества ПДФ, что мешает образованию полноценного свертка фибрина.СтадиюIVназывают восстановительной, или стадией остаточных проявлений блокады сосудов. Для нее характерны дистрофические и некротические изменения в тканях: кортикальный некроз почек, геморрагический некроз надпочечников; некроз гипофиза, очаговый панкреонекроз, язвенный энтероколит. Клинические признаки этой стадии зависят от выраженности нарушений микроциркуляции и от степени повреждения паренхимы и стромы в том или ином органе. При благоприятном течении синдрома эта стадия завершается выздоровлением, при неблагоприятном — развитием органной недостаточности: острой легочной, почечной, печеночной, надпочечниковой. ПАТОЛОГИЧЕСКАЯ АНАТОМИЯ И МОРФОГЕНЕЗ.Морфология и морфогенез ДВС-синдрома обусловлены рядом факторов, среди которых важную роль играют: 1) основное заболевание; 2) пусковые механизмы ДВС; 3) длительность процесса; 4) лечебные мероприятия, проводимые по поводу коагулопатии.Независимо от сочетания этих факторов основными морфологическими проявлениями ДВС-синдрома служат микротромбы, некрозы и кровоизлияния.Микротромбы. Состав и строение их не соответствуют структуре тромба в крупных сосудах. Описывают фибриновые, гиалиновые, глобулярные, тромбоцитарные, лейкоцитарные и эритроцитарные тромбы.Решающая роль при диагностике ДВС отводится ф и б р и -новым микротромбам. Они представляют собой округлые или цилиндрические образования, имеющие петлистое либо волокнистое строение. Лишь изредка между нитями фибрина обнаруживаются единичные эритроциты. Значительное количество фибриновых микротромбов встречается у больных, ДВС-синдром у которых развивался постепенно, т.е. I стадия (гиперкоагуляция) была довольно длительной. Считают, что в морфогенезе чисто фибриновых тромбов происходит правильное чередование всех этапов свертывания крови, завершающееся формированием стабилизированного свертка крови.Гиалиновые тромбы, как считают большинство исследователей, также состоят преимущественно из фибрина. Однако, как показали результаты иммуногистохимических и электронно-микроскопических исследований, в состав гиалиновых тромбов наряду с фибрином входит фибриноген. Ультраструктурно они отличаются от обычных фибриновых тромбов степенью полимеризации. Эти гомогенные округлые образования встречаются во всех отделах микроциркуляторного русла, однако преимущественно локализуются в капиллярах. Возникновение гиалиновых тромбов связывают с уплотнением фибрина при продвижении в более мелкие сосуды. Возможно также, что имеет место нарушение формирования фибринового свертка во II— III стадиях, когда происходит активация фибринолитической системы и в крови циркулируют ПДФ, мешающие нормальной полимеризации фибрина.Глобулярные тромбы локализуются в различных отделах микроциркуляторного русла. Каркасом для их образования служат сладжированные эритроциты, на которые откладываются фибриновые массы. В ходе образования этого вида тромбов эритроциты гемолизируются, поэтому видны лишь их оболочки, которые иногда полностью разрушаются. Эритроцитарный сладж — обязательный этап в возникновении глобулярных тромбов, поэтому они обнаруживаются у большинства больных с локальными или общими нарушениями кровообращения, сопровождающимися повышением коагуляционного потенциала крови.Тромбоцитарные (пластинчатые) тромбы — частое проявление внутрисосудистой коагуляции. Они представляют собой окрашиваемые эозином зернистые массы, среди которых обнаруживаются отдельные нити фибрина, могут включаться также единичные эритроциты и лейкоциты. Такиетромбы нередко обтурируют даже крупные сосуды. В клинической практике их наличие патогномонично для ДВС при эмболии околоплодными водами. В эксперименте отмечено, что тромбоцитарные тромбы образуются чаще всего в месте повреждения эндотелия сосудов вследствие его травмы или токсического воздействия.Лейкоцитарным (белым) тромбам отводится важное место среди морфологических проявлений ДВС-синдрома. Они обнаруживаются в венулах кожи при менингококкемии и лейкозах (лейкозные тромбы). Состоят преимущественно из клеток миелоидного ряда, скрепленных нитями фибрина. Чаще всего лейкоцитарные тромбы обнаруживаются в венозном конце сосудистого русла (медленный ток крови способствует их образованию).Эритроцитарные (красные) тромбы встречаются в различных внутренних органах и на всех участках микроциркуляторного русла чаще при перитоните, шоке и некоторых других состояниях. Как и классические тромбы, состоят из фибрина, тромбоцитов и большого количества гемолизированных эритроцитов. Термин "эритроцитарный тромб" лишь подчеркивает, что основным компонентом тромба являются эритроциты. Морфологические изменения в органах и причины смерти. В финале развития ДВС-синдрома возникают два типа нарушений, которые зависят от его распространенности, локализации и степени выраженности: 1) геморрагический диатез как результат коагулопатии потребления и активации фибринолиза; 2) некрозы вследствие нарушения кровотока в микроциркуляторном русле различных органов с нарушением их функции. Многообразие этиологических факторов, нозологических форм, патогенетических процессов, приводящих к развитию ДВС-синдрома, обусловили многогранность проявлений внутрисосудистой коагуляции, участие в процессе различных органов и систем.Наиболее часто поражаются почки, легкие и надпочечники, значительно реже — печень, поджелудочная железа, желудочно-кишечный тракт, кожа, аденогипофиз, в единичных случаях признаки внутрисосудистого свертывания отмечены в миокарде, головном мозге. Особое место среди пораженных органов занимает селезенка.Почкиувеличены в размерах, набухшие, корковое вещество бледное с серо-желтым оттенком, при длительности процесса 2—3 сут нередко видны очаговые или тотальные кортикальные некрозы, окруженные зоной гиперемии и кровоизлияний. Часты субкапсулярные кровоизлияния. Определяются выраженные дистрофические изменения эпителия канальцев вплоть до развития некробиоза и некроза. В микроциркуляторном русле микро-тромбы в капиллярах клубочков, приводящих и отводящих артериолах, сосудах мозгового вещества. Тромбы могут быть чисто фибриновыми, гиалиновыми, глобулярными, эритроцитарными или смешанными (фибрино-эритроцитарными). В ряде случаев при наличии выраженных изменений в канальцах микротромбы не обнаруживаются.В легких при ДВС-синдроме внутрисосудистая коагуляция выражена наиболее ярко. Встречаются все варианты микротромбов, а также агрегация, сладж и агглютинация форменных элементов крови. Объясняется это тем, что легкие являются своеобразным сосудистым фильтром, который задерживает инородные частицы, встречающиеся в кровотоке и служащие триггером для запуска ДВС-синдрома — чешуйки, сыровидная смазка при эмболии околоплодными водами, капельки жира при жировой эмболии, клетки синцитиотрофобласта при преждевременной отслойке плаценты, клетки злокачественных опухолей при гематогенном метастазировании или тканевой эмболии. Все другие макро- и микроскопические признаки (резкое полнокровие, отек, скопление альвеолярных макрофагов и кровоизлияния в альвеолы), часто обнаруживаемые при ДВС-синдроме, считаются неспецифичными.Надпочечники также являются одним из основных органов, поражаемых при ДВС ("шоковый орган"). Как правило, определяется окклюзия микроциркуляторного русла, которая приводит к выраженной дистрофии вплоть до некроза клеток коркового и мозгового вещества. Микротромбы обычно сочетаются с множественными кровоизлияниями — от точечных до обширных, захватывающих всю толщу органа и ведущих к деструкции ткани надпочечника. Часто обнаруживаются кровоизлияния в капсуле и окружающей жировой клетчатке.В печени при ДВС обнаруживается сочетание поражения паренхимы с внутрисосудистой коагуляцией, но нередко имеет место повреждение гепатоцитов без обтурации сосудов микротромбами. Изменения гепатоцитов обычо резко выражены в центрах долек, где часто развиваются центролобулярные некрозы. Последние нередко сочетаются с кровоизлияниями, что придает органу пестрый вид. Наиболее частым проявлением ДВС в печени являются тяжи и нити фибрина, свободно лежащие в печеночных синусоидах. В центральных венах встречаются часто фибриновые тромбы. Другие виды микротромбов в сосудах печени наблюдаются редко.Повреждение поджелудочной железы при ДВС-синдроме может варьировать от минимального до панкреонекроза. Степень повреждения железы коррелирует с выраженностью микротромбов. Выход ферментов при панкреонекрозе поддерживает процесс внутрисосудистой коагуляции и ведет к формированию новых микротромбов в железе.В желудочно-кишечном тракте характерными проявлениями ДВС-синдрома являются кровоизлияния в слизистую оболочку, эрозии, иногда острые язвы. В микроциркуляторном русле желудка и тонкой кишки обнаруживаются резкое полнокровие, сладж и агглютинация эритроцитов; изредка выявляются чисто фибриновые и эритроцитарные микротромбы.Кожные проявления ДВС-синдрома носят преимущественно геморрагический характер: петехиальная, мелко- и крупнопетлистая, иногда сливная геморрагическая сыпь, множественные кровоизлияния в местах инъекций, операционных разрезах. Иногда в центре высыпаний можно обнаружить очаги некроза. При гистологическом исследовании находят единичные фибриновые, лейкоцитарные и смешанные микротромбы сосудов дермы.Для поражения аденогипофиза характерна распространенная внутрисосудистая коагуляция с образованием гиалиновых и чисто фибриновых тромбов, приводящая к дистрофии и некрозу клеток передней доли гипофиза, что у выживших больных приводит к гипофизарной недостаточности (синдром Шихена).В миокарде проявление распространенного свертывания крови наблюдается редко. Единичные гиалиновые микротромбы обтурируют капилляры. Довольно часто обнаруживают геморрагии под эпи- и эндокардом.В головном мозге микротромбы выявляются редко; чаще они встречаются в мягких мозговых оболочках, а также в сосудистых сплетениях и имеют характер чисто фибриновых и гиалиновых.В селезенке морфологические признаки внутрисосудистой коагуляции имеются в мелких внутриорганных артериях и венах (гиалиновые и чисто фибриновые тромбы), синусоидах (тяжи и нити фибрина). В фолликулах определяются белковые массы, содержащие фибрин. Геморрагический синдром также находит свое отражение: постоянно обнаруживаются кровоизлияния в пульпу органа и под капсулу.
|
studopedya.ru