Содержание
Точка эквивалентности | это… Что такое Точка эквивалентности?
Точка эквивалентности (в титриметрическом анализе) — момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце. В некоторых случаях наблюдают несколько точек эквивалентности, следующих одна за другой, например, при титровании многоосновных кислот или же при титровании раствора, в котором присутствует несколько определяемых ионов.
На графике кривой титрования присутствует одна или несколько точек перегиба, соответствующих точкам эквивалентности.
Точкой окончания титрования (подобна точке эквивалентности, но не то же самое) считают момент, при котором индикатор изменяет свой цвет при колориметрическом титровании.
Содержание
|
Методы определения точки эквивалентности
С помощью индикаторов
Это вещества, изменяющие свой цвет вследствие протекания химических процессов. Кислотно-основные индикаторы, например фенолфталеин, изменяют свой цвет в зависимости от pH раствора, в котором они находятся. Редокс-индикаторы изменяют свой цвет вслед за изменением потенциала системы, используются таким образом при окислительно-восстановительном титровании. Перед началом титрования в исследуемый раствор добавляют несколько капель индикатора и начинают по каплям добавлять титрант. Как только раствор вслед за индикатором изменяет свой цвет, титрование прекращают, этот момент приблизительно и есть точка эквивалентности.
Правило выбора индикатора — при титровании используется такой индикатор, который изменяет свою окраску около точки эквивалентности, т. е. интервал перехода окраски индикатора должен по возможности совпадать со скачком титрования.
е. интервал перехода окраски индикатора должен по возможности совпадать со скачком титрования.
Потенциометрия
В данном случае используют прибор для измерения электродного потенциала раствора. При достижении точки эквивалентности потенциал рабочего электрода резко изменяется.
С помощью pH-метров
pH-метр по сути своей также является потенциметром, в котором используется электрод, потенциал которого зависит от содержания в растворе ионов H+, это пример использования ионоселективного электрода. Таким образом можно следить за изменением pH в течение всего процесса титрования. При достижении точки эквивалентности pH резко изменяется. Данный способ более точный по сравнению с титрованием с использованием кислотно-основных индикаторов, и может быть легко автоматизирован.
Проводимость
Проводимость раствора электролитов зависит от находящихся в нем ионов. Во время титрования проводимость часто значительно изменяется (Например, при кислотно-основном титровании, ионы H+ и OH− взаимодействуют, образуя нейтральную молекулу H2O, что вызывает изменение проводимости раствора). Общая проводимость раствора зависит и от других присутствующих ионов (например, противоинов), которые вносят в нее различный вклад. Он, в свою очередь, зависит от подвижности каждого иона и от общей концентрации ионов (ионной силы). В связи с этим предсказать изменение проводимости гораздо сложнее, нежели измерить ее.
Общая проводимость раствора зависит и от других присутствующих ионов (например, противоинов), которые вносят в нее различный вклад. Он, в свою очередь, зависит от подвижности каждого иона и от общей концентрации ионов (ионной силы). В связи с этим предсказать изменение проводимости гораздо сложнее, нежели измерить ее.
Изменение цвета
При протекании некоторых реакций происходит изменение цвета и без добавления индикатора. Чаще всего это наблюдается при окислительно-восстановительном титровании, когда исходные вещества и продукты реакции имеют разные цвета в разных степенях окисления.
Осаждение
Если во время реакции образуется твердое нерастворимое вещество, то по окончании титрования образуется преципитат. Классическим примером такой реакции является образование крайне нерастворимого хлористого серебра AgCl из ионов Ag+ и Cl−. Удивительно, но это не позволяет точно определить момент окончания титрования, поэтому осадительное титрование чаще всего используют в качестве обратного титрования.
Изотермическое калориметрическое титрование
Используется изотермический титровальный калориметр, который по величине тепла, которое выделила или поглотила реагирующая система, определяет точку эквивалентности. Данный способ важен в биохимическом титровании, например, для определения того, как ферментный субстрат связывается с ферментом.
Термометрическая титриметрия
Термометрическая титриметрия — чрезвычайно гибкая техника. Она отличается от калориметрической титриметрии тем, что теплота реакции, о которой свидетельствует падение или рост температуры, не используется для определения количества содержащегося в исследуемом образце раствора вещества. Напротив, точка эквивалентности определяется на основе области, в которой происходит изменение температуры. В зависимости от того, является реакция между титрантом и исследуемым веществом экзотермической или эндотермической, температура в течение процесса титрования будет, соответственно, возрастать или падать. Когда все исследуемое вещество прореагировало с титрантом, изменение области, в которой происходит рост или падение температуры, позволяет определить точку эквивалентности и изгиб на кривой температуры. Точно точку эквивалентности можно определить, взяв вторую производную кривой температуры: четкий пик будет указывать на точку эквивалентности.
Когда все исследуемое вещество прореагировало с титрантом, изменение области, в которой происходит рост или падение температуры, позволяет определить точку эквивалентности и изгиб на кривой температуры. Точно точку эквивалентности можно определить, взяв вторую производную кривой температуры: четкий пик будет указывать на точку эквивалентности.
Спектроскопия
Точку эквивалентности можно определить, измеряя абсорбцию света раствором во время титровании, если известен спектр продукта, титранта или исследуемого вещества. Относительное содержание продукта реакции и исследуемого вещества позволяют определить точку эквивалентности. При этом присутствие свободного титранта (указывающее на завершение реакции) можно обнаружить при очень малых величинах.
Амперометрия
Метод, позволяющий определить точку эквивалентности по величине тока при заданном потенциале. Величина тока вследствие реакции окисления/восстановления исследуемого вещества или продукта у рабочего электрода зависит от их концентрации в растворе. Точке эквивалентности соответствует изменение величины тока. Данный метод наиболее полезен, когда необходимо уменьшить расход титранта, например, при титровании галидов ионом Ag+.
Точке эквивалентности соответствует изменение величины тока. Данный метод наиболее полезен, когда необходимо уменьшить расход титранта, например, при титровании галидов ионом Ag+.
Вид кривой титрования
Типичный вид кривой титрования двухосновной щавелевой кислоты сильным основанием (гидроксидом натрия). Видны обе точки эквивалентности
См. также
- Методы электроаналитической химии
Точка эквивалентности | это… Что такое Точка эквивалентности?
Точка эквивалентности (в титриметрическом анализе) — момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце. В некоторых случаях наблюдают несколько точек эквивалентности, следующих одна за другой, например, при титровании многоосновных кислот или же при титровании раствора, в котором присутствует несколько определяемых ионов.
На графике кривой титрования присутствует одна или несколько точек перегиба, соответствующих точкам эквивалентности.
Точкой окончания титрования (подобна точке эквивалентности, но не то же самое) считают момент, при котором индикатор изменяет свой цвет при колориметрическом титровании.
Содержание
|
Методы определения точки эквивалентности
С помощью индикаторов
Это вещества, изменяющие свой цвет вследствие протекания химических процессов. Кислотно-основные индикаторы, например фенолфталеин, изменяют свой цвет в зависимости от pH раствора, в котором они находятся. Редокс-индикаторы изменяют свой цвет вслед за изменением потенциала системы, используются таким образом при окислительно-восстановительном титровании. Перед началом титрования в исследуемый раствор добавляют несколько капель индикатора и начинают по каплям добавлять титрант. Как только раствор вслед за индикатором изменяет свой цвет, титрование прекращают, этот момент приблизительно и есть точка эквивалентности.
Перед началом титрования в исследуемый раствор добавляют несколько капель индикатора и начинают по каплям добавлять титрант. Как только раствор вслед за индикатором изменяет свой цвет, титрование прекращают, этот момент приблизительно и есть точка эквивалентности.
Правило выбора индикатора — при титровании используется такой индикатор, который изменяет свою окраску около точки эквивалентности, т.е. интервал перехода окраски индикатора должен по возможности совпадать со скачком титрования.
Потенциометрия
В данном случае используют прибор для измерения электродного потенциала раствора. При достижении точки эквивалентности потенциал рабочего электрода резко изменяется.
С помощью pH-метров
pH-метр по сути своей также является потенциметром, в котором используется электрод, потенциал которого зависит от содержания в растворе ионов H+, это пример использования ионоселективного электрода. Таким образом можно следить за изменением pH в течение всего процесса титрования. При достижении точки эквивалентности pH резко изменяется. Данный способ более точный по сравнению с титрованием с использованием кислотно-основных индикаторов, и может быть легко автоматизирован.
При достижении точки эквивалентности pH резко изменяется. Данный способ более точный по сравнению с титрованием с использованием кислотно-основных индикаторов, и может быть легко автоматизирован.
Проводимость
Проводимость раствора электролитов зависит от находящихся в нем ионов. Во время титрования проводимость часто значительно изменяется (Например, при кислотно-основном титровании, ионы H+ и OH− взаимодействуют, образуя нейтральную молекулу H2O, что вызывает изменение проводимости раствора). Общая проводимость раствора зависит и от других присутствующих ионов (например, противоинов), которые вносят в нее различный вклад. Он, в свою очередь, зависит от подвижности каждого иона и от общей концентрации ионов (ионной силы). В связи с этим предсказать изменение проводимости гораздо сложнее, нежели измерить ее.
Изменение цвета
При протекании некоторых реакций происходит изменение цвета и без добавления индикатора. Чаще всего это наблюдается при окислительно-восстановительном титровании, когда исходные вещества и продукты реакции имеют разные цвета в разных степенях окисления.
Осаждение
Если во время реакции образуется твердое нерастворимое вещество, то по окончании титрования образуется преципитат. Классическим примером такой реакции является образование крайне нерастворимого хлористого серебра AgCl из ионов Ag+ и Cl−. Удивительно, но это не позволяет точно определить момент окончания титрования, поэтому осадительное титрование чаще всего используют в качестве обратного титрования.
Изотермическое калориметрическое титрование
Используется изотермический титровальный калориметр, который по величине тепла, которое выделила или поглотила реагирующая система, определяет точку эквивалентности. Данный способ важен в биохимическом титровании, например, для определения того, как ферментный субстрат связывается с ферментом.
Термометрическая титриметрия
Термометрическая титриметрия — чрезвычайно гибкая техника. Она отличается от калориметрической титриметрии тем, что теплота реакции, о которой свидетельствует падение или рост температуры, не используется для определения количества содержащегося в исследуемом образце раствора вещества. Напротив, точка эквивалентности определяется на основе области, в которой происходит изменение температуры. В зависимости от того, является реакция между титрантом и исследуемым веществом экзотермической или эндотермической, температура в течение процесса титрования будет, соответственно, возрастать или падать. Когда все исследуемое вещество прореагировало с титрантом, изменение области, в которой происходит рост или падение температуры, позволяет определить точку эквивалентности и изгиб на кривой температуры. Точно точку эквивалентности можно определить, взяв вторую производную кривой температуры: четкий пик будет указывать на точку эквивалентности.
Напротив, точка эквивалентности определяется на основе области, в которой происходит изменение температуры. В зависимости от того, является реакция между титрантом и исследуемым веществом экзотермической или эндотермической, температура в течение процесса титрования будет, соответственно, возрастать или падать. Когда все исследуемое вещество прореагировало с титрантом, изменение области, в которой происходит рост или падение температуры, позволяет определить точку эквивалентности и изгиб на кривой температуры. Точно точку эквивалентности можно определить, взяв вторую производную кривой температуры: четкий пик будет указывать на точку эквивалентности.
Спектроскопия
Точку эквивалентности можно определить, измеряя абсорбцию света раствором во время титровании, если известен спектр продукта, титранта или исследуемого вещества. Относительное содержание продукта реакции и исследуемого вещества позволяют определить точку эквивалентности. При этом присутствие свободного титранта (указывающее на завершение реакции) можно обнаружить при очень малых величинах.
Амперометрия
Метод, позволяющий определить точку эквивалентности по величине тока при заданном потенциале. Величина тока вследствие реакции окисления/восстановления исследуемого вещества или продукта у рабочего электрода зависит от их концентрации в растворе. Точке эквивалентности соответствует изменение величины тока. Данный метод наиболее полезен, когда необходимо уменьшить расход титранта, например, при титровании галидов ионом Ag+.
Вид кривой титрования
Типичный вид кривой титрования двухосновной щавелевой кислоты сильным основанием (гидроксидом натрия). Видны обе точки эквивалентности
См. также
- Методы электроаналитической химии
4.3: Эквивалентная система сопряжения сил
- Последнее обновление
- Сохранить как PDF
- ID Page
- 50587
- Jacob Moore & Antormors
- Университет штата Пенсильвания Мон Альто через Mechanics Map
Каждый набор сил и моментов имеет эквивалентную систему пары сил . Это единственная сила и чистый момент (пара), действующие в одной точке, что статически эквивалентно исходному набору сил и моментов.
Это единственная сила и чистый момент (пара), действующие в одной точке, что статически эквивалентно исходному набору сил и моментов.
Рисунок \(\PageIndex{1}\): Любой набор сил, действующих на тело, можно заменить одной силой и одной парой действующих сил, которые статически эквивалентны исходному набору сил и моментов. Этот набор эквивалентной силы и пары известен как система эквивалентной пары сил.
Чтобы найти эквивалентную систему пары сил, вам просто нужно выполнить следующие шаги.
- Сначала выберите точку, вокруг которой будет находиться система эквивалентной пары сил. Любая точка будет работать, но точка, которую вы выберете, повлияет на окончательные значения, которые вы найдете для системы эквивалентной пары сил. Традиционно эта точка будет либо центром масс тела, либо некоторой точкой соединения тела.
- Затем сопоставьте все силы, не действующие через эту точку, с силой и парой, действующей в выбранной вами точке.
- Чтобы найти «силовую» часть системы эквивалентной пары сил, сложите все векторы сил.
 Это даст вам величину и направление силы в системе эквивалентной пары сил.
Это даст вам величину и направление силы в системе эквивалентной пары сил. - Чтобы найти «парную» часть системы эквивалентных пар сил, сложите любые векторы моментов (это могут быть моменты, изначально действующие на тело, или моменты от разложения сил на силы и пары). Это даст вам величину и направление чистого момента (пары) в системе эквивалентной пары сил.
Пример \(\PageIndex{1}\)
Найдите эквивалентную систему пары сил для показанных ниже сил относительно точки A.
Рисунок \(\PageIndex{2}\): схема задачи для примера \(\PageIndex{1 }\). L-образная деталь, два плеча которой соединяются в точке A, испытывает силу, направленную вправо, и момент, направленный против часовой стрелки относительно конца ее вертикального плеча, а также две направленные вниз силы вдоль его горизонтального плеча.
- Решение
- Видео \(\PageIndex{2}\): рабочее решение примера проблемы \(\PageIndex{1}\), предоставленное доктором Джейкобом Муром. Источник YouTube: https://youtu.be/cw-rwBZef5w.
Эта страница под названием 4.3: Equivalent Force Couple System распространяется по лицензии CC BY-SA 4.0 и была создана, изменена и/или курирована Джейкобом Муром и участниками (Mechanics Map) с помощью исходного контента, который был отредактирован в соответствии со стилем и стандарты платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джейкоб Мур и авторы
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать оглавление
- нет
- Теги
- эквивалентная силовая пара
- источник@http://mechanicsmap.
 psu.edu
psu.edu
ньютоновская механика — Эквивалентность системы силовых пар: 3 уравнения моментов
Итак, у нас есть три точки на плоскости с координатами $$ \begin{aligned} \mathbf{r}_A & = \pmatrix{x_A\\y_A\\0} & \mathbf{r}_B & = \pmatrix {x_B\\y_B\\0} & \mathbf{r}_C & = \pmatrix{x_C\\y_C\\0} \end{aligned} $$
Сила действует с линией действия , перпендикулярной к самолету
$$\begin{выровнено}
\mathbf{F} & = \pmatrix{0\\0\\F} &
\mathbf{r} & = \pmatrix{х \\ у \\ 0}
\end{aligned}$$
Но мы не знаем ни величины силы, ни местоположения. Но из любых двух из трех равнозначных моментов
$$ \begin{выровнено}
\mathbf{M}_A & = \left(\mathbf{r}-\mathbf{r}_A\right) \times \mathbf{F} \\
\mathbf{M}_B & = \left(\mathbf{r}-\mathbf{r}_B\right) \times \mathbf{F} \\
\mathbf{M}_C & = \left(\mathbf{r}-\mathbf{r}_C\right) \times \mathbf{F} \\
\end{aligned}$$ мы выводим силу, используя тот факт, что $\mathbf{M}_B — \mathbf{M}_A = \left(\mathbf{r}_A-\mathbf{r}_B \right) \times\mathbf{F}$ 92 } \\
& \equiv\mathbf{M}_B — \mathbf{M}_A
\end{aligned} $$
Используйте векторное тройное произведение $a\times(b \times c) = b (a\cdot c) — c (a\cdot b)$
Сокращение $\ left(\mathbf{r}_B-\mathbf{r}_A \right) \cdot\left(\mathbf{M}_B-\mathbf{M}_A\right)$ может быть доказано определением равноправных моментов .
 5 Изменение цвета
5 Изменение цвета Это даст вам величину и направление силы в системе эквивалентной пары сил.
Это даст вам величину и направление силы в системе эквивалентной пары сил.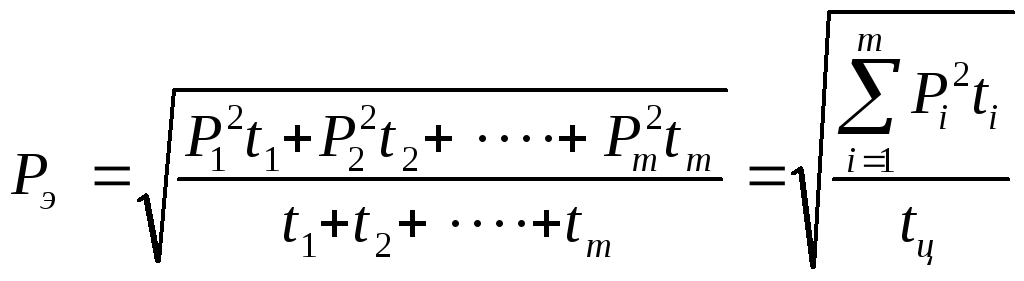 psu.edu
psu.edu