Содержание
Двигатель JQMA, JQMB — MOTORTOP [Энциклопедия ДВС и КПП]
Информация для клиентов
Купить контрактный двигатель JQMA, JQMB без предоплаты вы можете на нашем сайте. Для этого оставьте заявку в соответствующем разделе и дождитесь звонка менеджера. Продажа контрактных двигателей Ford осуществляется с полным пакетом документов для постановки на учет в ГИБДД. Работаем со всеми регионами России, Беларуси и Казахстана.
Технические характеристики
| Технические характеристики | |
|---|---|
| Объем (см3) | 1596 |
| Мощность (л.с.) | 150 |
| Крутящий момент | 240 Нм |
| Привод ГРМ | Ремень |
| Экологический класс | Евро 5/6 |
| Тип топлива | Бензин АИ-95 |
| Особенности ДВС | DOHC |
| Система питания | Прямой впрыск |
| Гидрокомпенсаторы | Нет |
| Блок цилиндров | Алюминиевый R4 |
| Головка блока цилиндров | Алюминиевая 16v |
| Диаметр цилиндра | 79 мм |
| Ход поршня | 81. 4 мм 4 мм |
| Степень сжатия | 10.1 |
| Фазорегулятор | На впуске и выпуске |
| Турбонаддув | BorgWarner KP39 |
| Моторное масло | 3.8 л 5W-20 |
| Средний ресурс | 250 000 км |
Применимость
Применимость двигателя JQMA, JQMB
- Ford: Kuga 2 (C520) 2012-2016
Описание
Описание двигателя JQMA, JQMB
Фордовский двигатель JQMA, JQMB производили с 2011 по 2019 год. И всё это время его устанавливали только на один автомобиль — на компактный кроссовер Ford Kuga.
Описание и главные достоинства
Мотор JQMA, JQMB обладает объёмом 1597 см3 и развивает до 150 л.с. Во многом такой мощности удаётся добиться благодаря стоящей здесь турбине BorgWarner KP39.
Конфигурация данного ДВС вполне стандартна — это рядная «четверка» с 16-клапанной ГБЦ. Кроме того, мотор оснащён системой непосредственного впрыска и ГРМ формата DOHC (с двумя распредвалами). Причём в качестве привода ГРМ здесь применяется ремень.
Кроме того, мотор оснащён системой непосредственного впрыска и ГРМ формата DOHC (с двумя распредвалами). Причём в качестве привода ГРМ здесь применяется ремень.
Следует также добавить, что двигатель JQMA, JQMB работает на бензине и соответствует экологическим стандартам Евро-5 или Евро-6 (в зависимости от года выпуска).
Перспективы тюнинга
Чип-тюнинг Stage 1 позволит увеличить мощность двигателя JQMA, JQMB со 150 до целых 195 «лошадок». А пиковый крутящий момент при этом возрастёт с 240 до 340 Нм.
Плюс ко всему после грамотного чип-тюнинга разгон от 0 до 100 км/ч будет осуществляться быстрее — вместо изначальных 9,6 на это понадобится 8,3 сек.
Вариант Stage 2 (он, как известно, предполагает, помимо всего прочего, доработку впускной и выпускной систем) здесь тоже возможен. И при воплощении в жизнь такого варианта можно получить до 204 л.с. и до 357 Нм.
При этом надо особо подчеркнуть, что на подобные цифры можно рассчитывать только в том случае, если в бак будет заливаться горючее с октановым числом от 98 или выше.
Недостатки
Недостатки и проблемы двигателя JQMA, JQMB
Один из главных минусов двигателя JQMA, JQMB — не слишком надёжный ремень ГРМ. Увы, он может оборваться уже в районе 80 000 км пробега. Водитель должен постоянно контролировать его состояние. Ведь обрыв этого самого ремня, если он всё-таки случится, непременно приведёт к встрече клапанов с поршнями.
Для улучшения экологических показателей здесь используется катализатор. И из-за низкокачественного бензина он, увы, может очень быстро засориться.
Кроме того, много головной боли тут может доставить муфта системы охлаждения. Автоконцерн Ford даже проводил несколько отзывных кампаний, связанных именно с конструктивными недостатками этой детали.
Наконец стоит сказать и о том, что в ГБЦ этого движка достаточно часто возникают трещины. Особенно это касается зон возле сёдел клапанов. Виной тому — банальное перегревание ДВС.
Видео
Интересные видео о двигателе JQMA, JQMB
6L JQMB 150л.с. 2013г 156000 пробега.» src=»https://www.youtube.com/embed/dw3ox-EcgIA?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»> Двигатель JQMA, JQMB
Узнать цену JQMA, JQMB
Получить консутальцию
Все двигатели FORD — модификации, характеристики, проблемы
Двигатели Ford
C-MAX
Ford C-MAX (Mk1)
shdc-hwda-hwdb-shda-shdb
g6dg-g6da-g6db-g6dd
hxda-sida
g8da-g8db
q7da-qqda-qqdb
Ford C-MAX (Mk2)
xtda
iqda-iqdb
muda
pnda
tyda
ufdb
txdb
m2da-sfda
m1da
EcoSport
Ford EcoSport
dragon
duratec-he
hxjd-iqjb
Edge
Ford Edge
duratec-35
Escape
Ford Escape
duratec-23
duratec-30
zetec
Ford Escape (R3)
duratec-23
duratec-25
duratec-30
Escort
Ford Escort
j4b-j6a
f4b
l1e
rda
rva
n7a
fuh-f4b
rte-rtf-rth
rfd-rfk
Explorer
Ford Explorer
duratec-ti-vct
ecoboost
cologne-v6-ohv-efi
triton-v8
cologne-v6
modular-v8
99x
windsor-v8
Ford Explorer (U152)
cologne-v6
modular-v8
F150
Ford F150
triton-v8
Fiesta
Ford Fiesta (Mk VI)
iqja-iqje
snjb-snja
u5ja
Ford Fiesta (Mk V)
m7ja-m7jb
fxja-fxjb
fyja-fyjb
Focus
Ford Focus (Mk 3)
m8da-m8db
iqdb
pnda
xtda
ufdb
xqda
t7db
m2da
m1da
xxdb
muda
ecoboost
jqda-jqdb-yuda
tyda
txdb
Ford Focus (C2)
Ford Focus
Ford Focus (Mk 2)
shdc-hwda-hwdb-shda-shdb
asda-asdb
sida
qqdb
kkda-kkdb
g6da-g6db-g6dd
g8da
q7da
ixda
jzda
Ford Focus (Mk 1)
fyda-fydb-fydc-fydd-fydh
fxda-fxdc-fxdb-fxdd
ffda
alda
hmda
Focus ST
Ford Focus ST (Mk 3)
r9da
Fusion
Ford Fusion
fxjc-fxja-fxjb
fyja-fyjb
f6ja-f6jb
fyja-fyjb-fyjc
25l-ivct-i-4
Galaxy
Ford Galaxy
aowb-aowa
tnwa
sewa
kkda
Grand C-MAX
Ford Grand C-MAX
pnda
jqda-jqdb
ufdb
Kuga
Ford Kuga 2
jqma-jqmb
m9ma
duratec-25
jtma
ufma
g6dg-ukda
txda
hydb
Maverick
Ford Maverick
duratec-23
duratec-30
Mondeo
Ford Mondeo (5)
tncc
r9cb-r9cf-r9ch
s7cb
Ford Mondeo (4)
aobc-aoba-tbba
tnba
tpba
seba
knba
kgba
q4ba
huba
kgba-pnba
Ford Mondeo (3)
chba-chbb
lcbd
reba
meba
Ford Mondeo (2)
l1l-l1n-l1q
rkb-rkf-rkh-rkj-rkk
rfn
nga-ngb-ngc-ngd
sea-lcbd-seb-sec
Ford Mondeo (1)
l1j
l1f
rkb
rka
rfn-rfm
nga
sea
Mustang
Ford Mustang
4v-ti-vct
duratec-37
coyote
Ranger
Ford Ranger
gbvajqj
gbvaf-gbvak-gbval
safa
wlaa
duratec
vulcan
cologne
S-MAX
Ford S-MAX
aowb-aowa
tnwa
tpwa
sewa
qywa
q4wa
huwa
Scorpio
Ford Scorpio (Mk2)
nsd
n3a
y5a
scc
brg
bob
Taurus
Ford Taurus
1
Tourneo Connect
Ford Tourneo Connect
p7pa-p7pb-r2pa-bhpa
eypd-eypa-eypc
Tourneo Custom
Ford Tourneo Custom
cyf4-cyff
Transit
duratorq-tdci
Платформа для флуорогенного скрининга обеспечивает направленную эволюцию инструмента для биосинтеза алкинов
Chem Commun (Camb). Авторская рукопись; доступно в PMC 2017 28 сентября.
Авторская рукопись; доступно в PMC 2017 28 сентября.
Опубликовано в окончательной редакции как:
Chem Commun (Camb). 2016 28 сентября; 52 (75): 11239–11242.
Опубликовано в Интернете 25 августа 2016 г. doi: 10.1039/c6cc05990b
PMCID: PMC5023497
NIHMSID: NIHMS813246
PMID: 2756 1030
, и , b , a , b, c и a, d
Информация об авторе Информация об авторских правах и лицензиях Отказ от ответственности 900 03
- Дополнительные материалы
Направленная эволюция использовалась для улучшения деятельности JamB, мембраносвязанной бифункциональной десатуразы/ацетиленазы. Чтобы быстро оценить результаты белковой инженерии, мы разработали новую платформу для количественного определения внеклеточных метаболитов, меченных алкинами, с помощью флуорогенной клик-реакции. Случайный мутагенез дал лучший вариант JamB, обеспечивающий примерно 20-кратное увеличение активности в Кишечная палочка .
Платформа флуорогенного скрининга позволила разработать мембраносвязанную бифункциональную десатуразу/ацетиленазу для улучшения активности в E. coli .
Алкиновая функциональность широко используется в химическом синтезе, фармацевтике и материалах благодаря своей уникальной реакционной способности 1, 2 . Кроме того, алкины, как биоортогональные ручки, также могут быть метаболически включены в биомолекулы для различных применений в химической биологии. Например, реакция циклоприсоединения азид-алкин [3+2] с образованием триазола (часто называемая клик-реакцией) и микроскопия комбинационного рассеяния алкинов позволили визуализировать и изучить механизм действия меченых алкином гликанов, белков, нуклеиновых кислот, липиды и натуральные продукты 3–9 . Однако распространенность алкиновой функциональности в синтетических молекулах и ее значение в химической биологии контрастируют с очень ограниченным числом известных инструментов биосинтеза алкинов 10–15 .
Недавно мы сообщили об обнаружении портативной кассеты тригена jamABC , которая способна продуцировать тиоактивированную 5-гексиноильную часть 14, 16 . Было показано, что JamB представляет собой слабую бифункциональную десатуразу/ацетиленазу, которая катализирует вставку концевой двойной связи, а затем концевой тройной связи на основе биохимического анализа. Эта генная кассета была в дальнейшем использована для генерация in situ и включение концевой алкиновой функциональности в пару каркасов натуральных продуктов в E. coli без подачи алкиновых предшественников. Например, неразборчивая поликетидсинтаза типа III (PKS), HsPKS1, могла принимать связанную с белком-носителем жирную ацильную часть, и, следовательно, поликетид с терминальной алкиновой меткой 1 был получен в штамме E. coli (названном как XZ1) при совместной экспрессии jamABC и hspks1 и подача 5-гексеновой кислоты 14 . В соответствии с биохимическим анализом in vitro , наше дальнейшее исследование in vivo показало, что при скармливании гексановой кислоты 1 продуцируется лишь в следовых количествах (~ 50 нМ), в то время как основной поликетидный метаболит 2 была получена фракция, которая имеет концевую алкановую функциональность, сохраненную от подаваемого алкана. Соединения 1 и 2 были произведены XZ1 в соотношении примерно 7:1000 ( и S1). Поскольку HsPKS1 не отдавал предпочтение стартовым установкам с иными терминальными функциональными возможностями, относительно низкая эффективность производства 1 , вероятно, был связан с низкой активностью мембраносвязанной бифункциональной десатуразы/ацетиленазы JamB в E. coli . Чтобы получить более эффективный ферментативный инструмент для биосинтеза алкинов, подход белковой инженерии, в частности направленная эволюция, был использован здесь для оптимизации активности десатуразы/ацетиленазы JamB в E.
В соответствии с биохимическим анализом in vitro , наше дальнейшее исследование in vivo показало, что при скармливании гексановой кислоты 1 продуцируется лишь в следовых количествах (~ 50 нМ), в то время как основной поликетидный метаболит 2 была получена фракция, которая имеет концевую алкановую функциональность, сохраненную от подаваемого алкана. Соединения 1 и 2 были произведены XZ1 в соотношении примерно 7:1000 ( и S1). Поскольку HsPKS1 не отдавал предпочтение стартовым установкам с иными терминальными функциональными возможностями, относительно низкая эффективность производства 1 , вероятно, был связан с низкой активностью мембраносвязанной бифункциональной десатуразы/ацетиленазы JamB в E. coli . Чтобы получить более эффективный ферментативный инструмент для биосинтеза алкинов, подход белковой инженерии, в частности направленная эволюция, был использован здесь для оптимизации активности десатуразы/ацетиленазы JamB в E. coli .
coli .
Открыть в отдельном окне
Обнаружение алкина в культурах E. coli с помощью флуорогенного зонда. а) Схема пути биосинтеза 1 в XZ1 и флуорогенная реакция с 4 . б) Азидофлуорогенные зонды ( 3 – 6 ), протестированные в этом исследовании. в) Флуоресценция культуральных супернатантов при реакции с 4 . Гетерологичные белки, экспрессированные в каждом штамме, показаны под соответствующими названиями штаммов. Однократное усиление флуоресценции соответствует сигналу, полученному от реакции с чистой средой (~500–1000 RFU). Столбики погрешностей представляют собой стандартные отклонения от трех измерений.
Чтобы быстро оценить результаты белковой инженерии JamB, мы разработали новый метод скрининга, основанный на количественном определении меченых алкинами метаболитов непосредственно в продуцирующих их клеточных культурах. Конструкция платформы для количественного определения состоит из двух компонентов: мечение секретируемых поликетидов путем инженерного биосинтеза с алкиновым фрагментом с последующей клик-реакцией с азидо-флуорогенным зондом (4). Флуорогенные зонды наделены функцией подавления флуоресценции 17–20 . Его трансформация во время клик-реакции создает новую функциональность, которая больше не подавляет флуоресценцию лежащей в основе системы, что приводит к усилению флуоресценции 17–20 . Такие зонды обладают значительными преимуществами по сравнению с флуоресцентными зондами для быстрого считывания меченого метаболита, когда смыть непрореагировавшие зонды невозможно. В частности, ожидается, что реакция азидофлуорогенного зонда с 1 приведет к усилению флуоресценции, которое зависит от количества 1 . Хотя флуорогенные клик-реакции применялись для визуализации и изучения макромолекул 17–20 , они не исследовались для количественного определения внеклеточных метаболитов из-за опасений по поводу специфичности реакции, селективности и чувствительности в сложных клеточных культурах.
Флуорогенные зонды наделены функцией подавления флуоресценции 17–20 . Его трансформация во время клик-реакции создает новую функциональность, которая больше не подавляет флуоресценцию лежащей в основе системы, что приводит к усилению флуоресценции 17–20 . Такие зонды обладают значительными преимуществами по сравнению с флуоресцентными зондами для быстрого считывания меченого метаболита, когда смыть непрореагировавшие зонды невозможно. В частности, ожидается, что реакция азидофлуорогенного зонда с 1 приведет к усилению флуоресценции, которое зависит от количества 1 . Хотя флуорогенные клик-реакции применялись для визуализации и изучения макромолекул 17–20 , они не исследовались для количественного определения внеклеточных метаболитов из-за опасений по поводу специфичности реакции, селективности и чувствительности в сложных клеточных культурах.
Открыть в отдельном окне
Иллюстрация платформы для скрининга мутантов JamB на основе количественного определения внеклеточных метаболитов с алкиновой меткой с использованием флуорогенной клик-реакции.
Для проверки реактивности азидофлуорогенных зондов с 1 мы культивировали XZ1 в среде F1 с добавлением 5-гексеновой кислоты в течение двух дней 14 , а затем бесклеточные супернатанты инкубировали с флуорогенным азидофлуоресцеином ( 3 900 68 ), катализатор Cu (I) генерировал in situ с использованием CuSO 4 , аскорбата и лиганда 2-[4-({бис[(1-трет-бутил-1H-1,2,3-триазол- 4-ил)метил]амино}метил)-1H-1,2,3-триазол-1-ил]уксусная кислота (БТТАА) 19 . Сигнал флуоресценции культуры XZ1 был примерно в 2 раза выше, чем у контроля только со средой (таблица S4), демонстрируя успех флуорогенной реакции, хотя и с ограниченным диапазоном ответа. Затем мы оценили эффективность дополнительных азидофлуорогенных зондов, включая di-pegOF ( 4 ), CalFluors 580 ( 5 ) и CalFluors 647 ( 6 ) 17 (). По сравнению с 3 , 4 – 6 продемонстрировали значительное усиление флуоресценции (более чем в 10 раз) при инкубации с супернатантом XZ1 (таблица S4).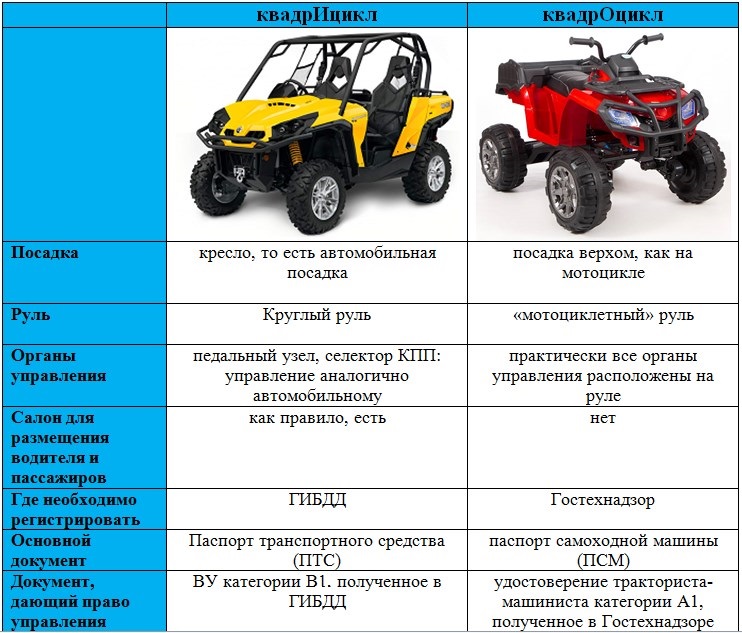 Среди всех испытанных зондов 4 дал наиболее последовательный и надежный ответ и поэтому был выбран для дальнейших применений. Также примечательно, что присутствие клеток в реакционной смеси значительно снижало усиление флуоресценции, вероятно, из-за вмешательства твердых веществ (таблица S4), и, таким образом, во всех последующих экспериментах использовались бесклеточные супернатанты.
Среди всех испытанных зондов 4 дал наиболее последовательный и надежный ответ и поэтому был выбран для дальнейших применений. Также примечательно, что присутствие клеток в реакционной смеси значительно снижало усиление флуоресценции, вероятно, из-за вмешательства твердых веществ (таблица S4), и, таким образом, во всех последующих экспериментах использовались бесклеточные супернатанты.
Чтобы подтвердить, что усиление флуоресценции связано с образованием соединений триазола, мы подготовили дополнительный контроль путем инкубации зонда 4 с культурами дополнительного штамма E. coli , в котором отсутствует jamB (названный XZ5). Ранее мы продемонстрировали, что этот контрольный штамм полностью устранял производство 1 14 . Не наблюдалось значительного усиления флуоресценции в культуре XZ5 по сравнению с контролем, содержащим только среду (1). Анализ ЖХ-МС высокого разрешения (ВР) показал, что реакция, содержащая XZ1, дает ожидаемое соединение триазола 7 со временем удерживания и массой, соответствующими характеристикам соединения, синтезированного химически с использованием 1 и 4 в качестве субстратов (рис. S2 и S8). По результатам ЖХ-МСВР в отрицательных контролях не наблюдалось значительного количества 7 , что согласуется с нашим обнаружением флуоресценции ( и S2).
S2 и S8). По результатам ЖХ-МСВР в отрицательных контролях не наблюдалось значительного количества 7 , что согласуется с нашим обнаружением флуоресценции ( и S2).
Затем мы решили определить предел обнаружения и диапазон линейного отклика для алкинов. Чтобы имитировать различные титры алкинов, мы добавили разные количества чистого алкина к бесклеточным супернатантам XZ5 и подвергли образцы флуорогенной клик-реакции. Наши результаты показали, что алкины могут быть обнаружены в таких низких количествах, как 50 нМ, и может быть достигнут широкий линейный диапазон ответа путем изменения количества флуорогенного зонда в анализах ( и S3). Мы также применили эту простую платформу количественного определения для мониторинга титра алкинов в различных культурах в течение 40 часов после индукции и подачи 5-гексеновой кислоты 9.0019 14 (). Как и ожидалось, сигнал флуоресценции культуры XZ1 неуклонно возрастал за счет увеличения титра алкинов. Напротив, усиления флуоресценции XZ5 не наблюдалось в течение всего времени.
Открыть в отдельном окне
Количественное определение алкинов в культурах E. coli с использованием 4 . а) Кривая количественного определения флуоресценции алкинов с использованием 0,75 мкМ 4 . На вставке показана линейная зависимость между кратностью усиления флуоресценции и концентрациями алкинов, R2=0,9.8.b) Мониторинг титра алкинов в культурах XZ1 и XZ5 во время ферментации на основе флуорогенного анализа. Однократное усиление флуоресценции соответствует сигналу, полученному от реакции с чистой средой (500~1000 RFU). Столбики погрешностей представляют собой стандартные отклонения от трех измерений.
Поскольку количественное определение алкинов на основе флуорогенного анализа работает как в больших колбах для встряхивания, так и в небольших 96-луночных культуральных планшетах, его можно использовать в качестве метода скрининга для улучшения активности JamB. Сначала мы создали библиотеку вариантов JamB, разнообразив jamB (~1 т. п.н.) случайным образом с использованием подверженной ошибкам ПЦР, так что средняя частота мутаций составляла 1,5 аминокислотных мутаций/т.п.н. Библиотека мутантов jamB была введена в XZ5, который совместно экспрессировал jamC , jamA и hspks1 . После скрининга ~1000 клонов мы выделили три клона (XZ1_1-XZ1_3), которые показали более высокие сигналы флуоресценции, чем контрольный штамм XZ1, экспрессирующий jamB дикого типа. Дальнейшее количественное определение LC-HRMS подтвердило увеличение титров 1 от этих мутантов ().
п.н.) случайным образом с использованием подверженной ошибкам ПЦР, так что средняя частота мутаций составляла 1,5 аминокислотных мутаций/т.п.н. Библиотека мутантов jamB была введена в XZ5, который совместно экспрессировал jamC , jamA и hspks1 . После скрининга ~1000 клонов мы выделили три клона (XZ1_1-XZ1_3), которые показали более высокие сигналы флуоресценции, чем контрольный штамм XZ1, экспрессирующий jamB дикого типа. Дальнейшее количественное определение LC-HRMS подтвердило увеличение титров 1 от этих мутантов ().
Открыть в отдельном окне
Производство штаммов 1 по E. coli , экспрессирующих jamB или его мутантов. (а) Относительная эффективность продукции 1 по сравнению со штаммом дикого типа (XZ1), когда все культуры подпитывались гексановой кислотой. Установлено, что эффективность JamB дикого типа в производстве соединения 1 в XZ1 составляет 100%. Столбики погрешностей представляют собой стандартные отклонения от трех измерений. ( б ) Модельная структура комплекса JamB-JamC. JamC и JamB показаны красным и бежевым соответственно. M1, M5 и I23 JamB выделены желтым, зеленым и синим цветом соответственно.
Столбики погрешностей представляют собой стандартные отклонения от трех измерений. ( б ) Модельная структура комплекса JamB-JamC. JamC и JamB показаны красным и бежевым соответственно. M1, M5 и I23 JamB выделены желтым, зеленым и синим цветом соответственно.
Анализ последовательности этих трех мутантов jamB показал, что мутанты JamB из XZ1_2 и XZ1_3 содержат по одной аминокислотной замене в M5V и I23M соответственно, в то время как мутант из XZ1_1 содержит три мутации в M5I, V189A и K250N. Затем мы исследовали вклад каждой аминокислотной мутации, обнаруженной в XZ1_1, сконструировав соответствующий одиночный мутант. Только M5I показал большой положительный эффект, тогда как V189A и K250N не имели очевидного эффекта, что согласуется с эффективностью мутанта M5V, обнаруженного в XZ1_2 (10). Чтобы исследовать влияние аминокислот с разными свойствами в этих двух положениях, мы создали дополнительные одиночные мутанты JamB, включая M5K, M5T, M5C, M5F, M5E, M5A, I23K, I23T, I23Y, I23V, I23E и I23C, посредством сайт-направленный мутагенез. Лучший мутант, JamB-M5T, повысил эффективность производства 1 примерно в 20 раз по сравнению с диким типом при введении гексановой кислоты (, S1 и S4). Эти результаты показали, что мутации в M5 и I23 превращают JamB в более эффективную бифункциональную десатуразу/ацетиленазу в E. coli . Также примечательно, что мутанты JamB, по-видимому, экспрессируются на уровнях, сравнимых с ферментом дикого типа, на основании анализа SDS-PAGE (рис. S5). Второй раунд направленной эволюции не привел к улучшенному мутанту, производящему алкин.
Лучший мутант, JamB-M5T, повысил эффективность производства 1 примерно в 20 раз по сравнению с диким типом при введении гексановой кислоты (, S1 и S4). Эти результаты показали, что мутации в M5 и I23 превращают JamB в более эффективную бифункциональную десатуразу/ацетиленазу в E. coli . Также примечательно, что мутанты JamB, по-видимому, экспрессируются на уровнях, сравнимых с ферментом дикого типа, на основании анализа SDS-PAGE (рис. S5). Второй раунд направленной эволюции не привел к улучшенному мутанту, производящему алкин.
Чтобы лучше понять молекулярный механизм полезных мутаций, которые привели к повышению эффективности образования алкинов, мы сопоставили M5 и I23 с смоделированной структурой комплекса JamB-JamC. Отдельные белковые структуры моделировали с использованием HHpred 21 с SCD1 22, 23 и CurA 24 в качестве шаблонов соответственно, а затем стыковали вместе с использованием ClusPro 25, 26 (и S6). Полученная структура показала, что I23 расположен на границе раздела двух белков, и, таким образом, I23M, вероятно, способствует взаимодействию между JamB и JamC. M5 находится рядом с N — конец JamB, и, что интересно, наша недавняя характеристика JamB и его гомологов CamB 14, 27 (идентичность/сходство = 95%/98%) и TtuB 15 (идентичность/сходство = 44%/ 60%) продемонстрировали, что на их активность в E. coli влияли аминокислоты в негомологичной N -концевой области (рис. S7). Это было дополнительно подтверждено конструированием химерных мутантов JamB с заменой N -концевой области на более эффективную десатуразу/ацетиленазу TtuB или менее эффективную CamB. Полученные мутанты JamB-TtuB и JamB-CamB показали повышенную и пониженную активность соответственно (), и эти данные подтверждают чувствительность ферментативной активности к N -концевые аминокислоты. Мы также предполагаем, что M5T может способствовать связыванию JamB с ферредоксином, возможным донором электронов 13, 28, 29 , поскольку недавняя кристаллическая структура мембраносвязанной десатуразы SCD1 предполагает, что ее N -конец лежит вдоль электронной канавка для связывания донора 23 .
Полученная структура показала, что I23 расположен на границе раздела двух белков, и, таким образом, I23M, вероятно, способствует взаимодействию между JamB и JamC. M5 находится рядом с N — конец JamB, и, что интересно, наша недавняя характеристика JamB и его гомологов CamB 14, 27 (идентичность/сходство = 95%/98%) и TtuB 15 (идентичность/сходство = 44%/ 60%) продемонстрировали, что на их активность в E. coli влияли аминокислоты в негомологичной N -концевой области (рис. S7). Это было дополнительно подтверждено конструированием химерных мутантов JamB с заменой N -концевой области на более эффективную десатуразу/ацетиленазу TtuB или менее эффективную CamB. Полученные мутанты JamB-TtuB и JamB-CamB показали повышенную и пониженную активность соответственно (), и эти данные подтверждают чувствительность ферментативной активности к N -концевые аминокислоты. Мы также предполагаем, что M5T может способствовать связыванию JamB с ферредоксином, возможным донором электронов 13, 28, 29 , поскольку недавняя кристаллическая структура мембраносвязанной десатуразы SCD1 предполагает, что ее N -конец лежит вдоль электронной канавка для связывания донора 23 .
Таким образом, используя преимущества реакции флуорогенного щелчка, мы разработали быструю и чувствительную аналитическую платформу, которая количественно определяет метаболиты, меченные внеклеточными алкинами, непосредственно в культурах ферментации. Мы также применили эту платформу в качестве метода скрининга для оптимизации инструмента биосинтеза алкинов с помощью белковой инженерии. В частности, была получена связанная с мембраной бифункциональная десатураза/ацетиленаза JamB, в результате чего был получен превосходный мутант с примерно 20-кратно улучшенной активностью десатуразы/ацетиленазы в 9 клетках.0005 Кишечная палочка . Этот результат не только способствует механистическому пониманию семейства мембраносвязанных бифункциональных десатураз/ацетиленаз, но также дает улучшенный инструмент биосинтеза терминальных алкинов, который можно широко использовать в синтетической и химической биологии 3–8 . Кроме того, этот метод обнаружения меченых алкином метаболитов с использованием азидофлуорогенных зондов может также способствовать открытию новых природных продуктов, содержащих алкины, и расширению инструментов биосинтеза алкинов.
ESI
Щелкните здесь для просмотра. (932K, pdf)
Это исследование было поддержано за счет грантов В. Чжана от Национальных институтов здравоохранения (DP2AT009148) и Фонда стипендиатов Хеллмана, а также гранта Национальных институтов здравоохранения (GM058867) для К. Р. Бертоцци. Мы благодарим профессора А. Аркина (Калифорнийский университет в Беркли) за щедрое использование его устройства для чтения микропланшетов и Дж. Лю (Калифорнийский университет в Беркли) за ценные предложения при подготовке рукописи.
† Доступна электронная дополнительная информация (ESI): экспериментальные методы, праймеры, штаммы, хроматограммы ЖХ-МСВР, продукция алкина дополнительными штаммами E. coli , экспрессирующими мутанты jamB . См. DOI: 10.1039/x0xx00000x
1. Hein CD, Liu X-M, Wang D. Pharm. Рез. 2008;25:2216–2230. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Binder WH, Kluger C. Curr. Орг. хим. 2006; 10: 1791–1815. [Google Scholar]
[Google Scholar]
3. Thirumurugan P, Matosiuk D, Jozwiak K. Chem. Ред. 2013; 113:4905–4979. [PubMed] [Google Scholar]
4. Grammel M, Hang HC. Нац. хим. биол. 2013; 9: 475–484. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Sletten EM, Bertozzi CR. Ангью. хим. Междунар. Эд. англ. 2009; 48: 6974–6998. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Wei L, Hu F, Shen Y, Chen Z, Yu Y, Lin CC, Wang MC, Min W. Nat. Мет. 2014; 11:410–412. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Prescher JA, Bertozzi CR. Нац. хим. биол. 2005; 1:13–21. [PubMed] [Академия Google]
8. Yan Y, Chen J, Zhang L, Zheng Q, Han Y, Zhang H, Zhang D, Awakawa T, Abe I, Liu W. Angew. хим. Междунар. Эд. англ. 2013;52:12308–12312. [PubMed] [Google Scholar]
9. Zhu X, Zhang W. Front. хим. 2015;3:11. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Lee M, Lenman M, Banaś A, Bafor M, Singh S, Schweizer M, Nilsson R, Liljenberg C, Dahlqvist A, Gummeson P-O, Sjödahl S, Green А, Стимне С. Наука. 1998; 280:915–918. [PubMed] [Google Scholar]
Наука. 1998; 280:915–918. [PubMed] [Google Scholar]
11. Fritsche K, van den Berg M, de Boer W, van Beek TA, Raaijmakers JM, van Veen JA, Leveau JHJ. Окружающая среда. микробиол. 2014;16:1334–1345. [PubMed] [Академия Google]
12. Haritos VS, Horne I, Damcevski K, Glover K, Gibb N, Okada S, Hamberg M. Nat. коммун. 2012;3:1150. [PubMed] [Google Scholar]
13. Minto RE, Blacklock BJ. прог. Липид Рез. 2008; 47: 233–306. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Zhu X, Liu J, Zhang W. Nat. хим. биол. 2015;11:115–120. [PubMed] [Google Scholar]
15. Zhu X, Su M, Manickam K, Zhang W. ACS Chem. биол. 2015;10:2785–2793. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Edwards DJ, Marquez BL, Nogle LM, McPhail K, Goeger DE, Roberts MA, Gerwick WH. хим. биол. 2004; 11:817–833. [PubMed] [Академия Google]
17. Ши П., Дьен В.Т., Беам Б.Дж., Кастеллано Дж.М., Висс-Корей Т., Бертоцци К.Р. Варенье. хим. соц. 2015; 137:7145–7151. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Shieh P, Bertozzi CR. Орг. биомол. хим. 2014;12:9307–9320. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Shieh P, Bertozzi CR. Орг. биомол. хим. 2014;12:9307–9320. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Shieh P, Hangauer MJ, Bertozzi CR. Варенье. хим. соц. 2012; 134:17428–17431. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Shieh P, Siegrist MS, Cullen AJ, Bertozzi CR. проц. Натл. акад. науч. США. 2014;111:5456–5461. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Сёдинг Дж., Бигерт А., Лупас А.Н. Нуклеиновые Кислоты Res. 2005;33:W244–W248. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Ван Х., Кляйн М.Г., Цзоу Х., Лейн В., Снелл Г., Левин И., Ли К., Санг Б.К. Нац. Структура Мол. биол. 2015; 22: 581–585. [PubMed] [Google Scholar]
23. Bai Y, McCoy JG, Levin EJ, Sobrado P, Rajashankar KR, Fox BG, Zhou M. Nature. 2015; 524: 252–256. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Busche A, Gottstein D, Hein C, Ripin N, Pader I, Tufar P, Eisman EB, Gu L, Walsh CT, Sherman DH, Lohr F, Guntert P, Dotsch V. ACS Chem. биол. 2012;7:378–386. [Бесплатная статья PMC] [PubMed] [Google Scholar]
ACS Chem. биол. 2012;7:378–386. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Комо С.Р., Гатчелл Д.В., Вайда С., Камачо С.Дж. Биоинформатика (Оксфорд, Англия) 2004; 20:45–50. [PubMed] [Google Scholar]
26. Comeau SR, Gatchell DW, Vajda S, Camacho CJ. Нуклеиновые Кислоты Res. 2004;32:W96–W99. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Джонс А.С., Монро Э.А., Поделл С., Хесс В.Р., Клагес С., Эскенази Э., Ниссен С., Гувер Х., Ротманн М., Ласкен Р.С., Йейтс М.Р., 3-й , Reinhardt R, Kube M, Burkart MD, Allen EE, Dorrestein PC, Gerwick WH, Gerwick L. Proc. Натл. акад. науч. США. 2011;108:8815–8820. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Wada H, Avelange-Macherel MH, Murata N. J Bacteriol. 1993; 175:6056–6058. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Wada H, Schmidt H, Heinz E, Murata N. J Bacteriol. 1993; 175: 544–547. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Исследование белково-ферментных взаимодействий ацил-носителя в терминальном алкиновом биосинтетическом механизме
1. Moses JE, Moorhouse AD. Растущее применение химии кликов. Chem Soc Rev. 2007;36(8):1249–1262. [PubMed] [Академия Google]
Moses JE, Moorhouse AD. Растущее применение химии кликов. Chem Soc Rev. 2007;36(8):1249–1262. [PubMed] [Академия Google]
2. Тирумуруган П., Матосюк Д., Йозвяк К. Химия кликов для разработки лекарств и различных химико-биологических применений. Chem Rev. 2013;113(7):4905–4979. [PubMed] [Google Scholar]
3. Prescher JA, Bertozzi CR. Химия в живых системах. Nat Chem Biol. 2005;1(1):13–21. [PubMed] [Google Scholar]
4. Wei L, Hu F, Shen Y, Chen Z, Yu Y, Lin CC, Wang MC, Min W. Визуализация живых клеток малых биомолекул с алкиновой меткой методом стимулированного комбинационного рассеяния. Нат Методы. 2014;11(4):410–412. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Zhu X, Liu J, Zhang W. De novo биосинтез природных продуктов, меченных терминальными алкинами. Nat Chem Biol. 2015;11(2):115–120. [PubMed] [Google Scholar]
6. Zhu X, Su M, Manickam K, Zhang W. Добыча генома бактерий из ферментативных инструментов для биосинтеза алкинов. ACS Chem Biol. 2015;10(12):2785–2793. [Бесплатная статья PMC] [PubMed] [Google Scholar]
ACS Chem Biol. 2015;10(12):2785–2793. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Mercer AC, Burkart MD. Вездесущий белок-носитель — окно для биосинтеза метаболитов. Nat Prod Rep. 2007;24(4):750–773. [PubMed] [Академия Google]
8. Нгуен С., Хаушалтер Р.В., Ли Д.Дж., Марквик П.Р., Брюггер Дж., Калдара-Фестин Г., Финзел К., Джексон Д.Р., Исикава Ф., О’Дауд Б., Маккаммон Дж.А., Опелла С.Дж., Цай С.К., Буркхарт М.Д. Захват динамического белка-носителя ацила в биосинтезе жирных кислот. Природа. 2014;505(7483):427–431. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Танович А., Самел С.А., Эссен Л.О., Марахиэль М.А. Кристаллическая структура модуля терминации нерибосомальной пептидсинтетазы. Наука. 2008;321(5889):659–663. [PubMed] [Академия Google]
10. Busche A, Gottstein D, Hein C, Ripin N, Pader I, Tufar P, Eisman EB, Gu L, Walsh CT, Sherman DH, Löhr F, Güntert P, Dötsch V. Характеристика молекулярных взаимодействий между ACP и галогеназные домены в поликетидсинтазе курацина А. ACS Chem Biol. 2012;7(2):378–386. [Бесплатная статья PMC] [PubMed] [Google Scholar]
ACS Chem Biol. 2012;7(2):378–386. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Уичер Дж. Р., Датта С., Хансен Д. А., Хейл В. А., Чемлер Дж. А., Дози А. М., Нараян А. Р., Хоканссон К., Шерман Д. Х., Смит Дж. Л., Скиниотис Г. Structural перестройки модуля поликетидсинтазы во время ее каталитического цикла. Природа. 2014;510(7506):560–564. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Барахас Дж.Ф., Финцель К., Валентик Т.Р., Шакья Г., Гамарра Н., Мартинес Д., Мейер Д.Л., Вагстад А.Л., Ньюман А.Г., Таунсенд К.А., Буркарт М.Д., Цай С.К. Структурный и биохимический анализ белок-белковых взаимодействий между белком-носителем ацила и матричным доменом продукта. Angew Chem Int Ed Engl. 2016;55(42):13005–13009. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Пфайфер Б.А., Адмирал С.Дж., Грамаджо Х., Кане Д.Е., Хосла С. Биосинтез сложных поликетидов в метаболически сконструированном штамме E. coli. Наука. 2001;291 (5509): 1790–1792. [PubMed] [Google Scholar]
14. Gao X, Xie X, Pashkov I, Sawaya MR, Laidman J, Zhang W, Cacho R, Yeates TO, Tang Y. Направленная эволюция и структурная характеристика симвастатинсинтазы. хим. биол. 2009;16(10):1064–1074. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Gao X, Xie X, Pashkov I, Sawaya MR, Laidman J, Zhang W, Cacho R, Yeates TO, Tang Y. Направленная эволюция и структурная характеристика симвастатинсинтазы. хим. биол. 2009;16(10):1064–1074. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Zhu X, Shieh P, Su M, Bertozzi CR, Zhang W. Платформа флуорогенного скрининга обеспечивает направленную эволюцию инструмента биосинтеза алкинов. Химическая коммуна (Кэмб). 2016;52(75):11239–11242. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Sievers F, Wilm A, Dineen D, Gibson TJ, Karplus K, Li WZ, Lopez R, McWilliam H, Remmert M, Söding J, Thompson JD, Higgins DG. Быстрое, масштабируемое создание высококачественных множественных выравниваний белков с помощью Clustal Omega. Мол Сист Биол. 2011;7(539):1–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Söding J, Biegert A, Lupas AN. Интерактивный сервер HHpred для определения гомологии белков и прогнозирования их структуры. Нуклеиновые Кислоты Res. 2005;33(2):W244–248. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Bai Y, McCoy JG, Levin EJ, Sobrado P, Rajashankar KR, Fox BG, Zhou M. Рентгеновская структура стеароил-КоА-десатуразы млекопитающих. Природа. 2015; 524(7564):252–256. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Wang H, Klein MG, Zou H, Lane W, Snell G, Levin I, Li K, Sang BC. Кристаллическая структура стеароил-кофермента А-десатуразы человека в комплексе с субстратом. Nat Struct Mol Biol. 2015;22(7):581–585. [PubMed] [Google Scholar]
20. Comeau SR, Gatchell DW, Vajda S, Camacho CJ. ClusPro: полностью автоматизированный алгоритм стыковки белок-белок. Нуклеиновые Кислоты Res. 2004;32(2):В96–W99. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Comeau SR, Gatchell DW, Vajda S, Camacho CJ. ClusPro: автоматизированный метод стыковки и дискриминации для предсказания белковых комплексов. Биоинформатика. 2004;20(1):45–50. [PubMed] [Google Scholar]
22. Pettersen EF, Goddard TD, Huang CC, Couch GS, Greenblatt DM, Meng EC, Ferrin TE. UCSF chimera — система визуализации для поисковых исследований и анализа. J Comput Chem. 2004;25(13):1605–1612. [PubMed] [Академия Google]
UCSF chimera — система визуализации для поисковых исследований и анализа. J Comput Chem. 2004;25(13):1605–1612. [PubMed] [Академия Google]
23. Lau J, Cane DE, Khosla C. Субстратная специфичность загружаемого дидомена поликетидсинтазы эритромицина. Биохимия. 2000;39(34):10514–10520. [PubMed] [Google Scholar]
24. Wittmann M, Linne U, Pohlmann V, Marahiel MA. Роль DptE и DptF в реакции липидирования даптомицина. ФЕБС Дж
2008;275(21):5343–5354. [PubMed] [Google Scholar]
25. Hansen DB, Bumpus SB, Aron ZD, Kelleher NL, Walsh CT. Загрузочный модуль микосубтилина: домен аденилирования с селективностью по жирным кислотам. J Am Chem Soc. 2007;129(20): 6366–6367. [PubMed] [Google Scholar]
26. Miao V, Brost R, Chapple J, She K, Gal MF, Baltz RH. Кластер генов биосинтеза липопептидного антибиотика A54145 из Streptomyces fradiae . J Ind Microbiol Biotechnol. 2006;33(2):129–140. [PubMed] [Google Scholar]
27. Powell A, Borg M, Amir-Heidari B, Neary JM, Thirlway J, Wilkinson B, Smith CP, Micklefield J. Инженерный биосинтез нерибосомных липопептидов с модифицированными боковыми цепями жирных кислот. J Am Chem Soc. 2007;129(49): 15182–15191. [PubMed] [Google Scholar]
Инженерный биосинтез нерибосомных липопептидов с модифицированными боковыми цепями жирных кислот. J Am Chem Soc. 2007;129(49): 15182–15191. [PubMed] [Google Scholar]
28. Harris NC, Sato M, Herman NA, Twigg F, Cai W, Liu J, Zhu X, Downey J, Khalaf R, Martin J, Koshino H, Zhang W. Биосинтез изонитрила липопептиды консервативными кластерами генов нерибосомальной пептидной синтетазы у актинобактерий. Proc Natl Acad Sci U S A. 2017;114(27):7025–7030. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Sandy M, Rui Z, Gallagher J, Zhang W. Ферментативный синтез дилактонового каркаса антимицинов. ACS Chem Biol. 2012;7(12):1956–1961. [PubMed] [Google Scholar]
30. Yan Y, Zhang L, Ito T, Qu X, Asakawa Y, Awakawa T, Abe I, Liu W. Биосинтетический путь для высокого структурного разнообразия общего ядра дилактона в производстве антимицина. Орг. лат. 2012;14(16):4142–4145. [PubMed] [Google Scholar]
31. Морита Х., Ямасита М., Ши С.П., Вакимото Т., Кондо С., Като Р.