Содержание
устройство, разновидности, назначение, принцип работы
Пример HTML-страницы
Аккумулятор представляет собой устройство, которое накапливает энергию в химической форме при подключении к источнику постоянного тока, а затем отдает ее, преобразуя в электричество. Его используют многократно за счет способности к восстановлению и обратимости химических реакций. Разряжается – снова заряжают. Применяются аккумуляторы в качестве автономных и резервных источников питания для электротехнического оборудования и различных устройств.
Устройство аккумулятора
В автомобилях обычно применяют свинцово-кислотные аккумуляторы. Рассмотрим их устройство.
Все элементы располагаются в корпусе, который изготавливают из полипропилена. Корпус состоит из емкости, разделенной на шесть ячеек, и крышки, оснащенной дренажной системой для стравливания давления и отвода газа. На крышку выводится два полюса (клеммы) – положительный и отрицательный.
Содержимое каждой ячейки представляет собой пакет из 16 свинцовых пластин, полярность которых чередуется. Восемь положительных пластин, объединенных бареткой, являются плюсовым электродом (катодом), восемь отрицательных – минусовым (анодом). Каждый электрод выводится к соответствующей клемме аккумулятора.
Восемь положительных пластин, объединенных бареткой, являются плюсовым электродом (катодом), восемь отрицательных – минусовым (анодом). Каждый электрод выводится к соответствующей клемме аккумулятора.
Пакеты пластин в ячейках погружены в электролит – раствор серной кислоты и воды плотностью 1,28 г/см3.
Между пластинами электродов, для предотвращения замыкания, вставлены сепараторы – пористые пластины, которые не препятствуют циркуляции электролита и не взаимодействуют с ним.
Отдельная пластина электрода – это решетка из металлического свинца, в которую впрессован (намазан) реагент. Активная масса катода – диоксид свинца (PbO2), анода – губчатый свинец.
Принцип действия аккумуляторов
Принцип действия аккумулятора основан на образовании разности потенциалов между двумя электродами, погруженными электролит. При подключении нагрузки (электротехнических устройств) к клеммам аккумулятора в реакцию вступают электролит и активные элементы электродов. Происходит процесс перемещения электронов, который, по сути, и является электротоком.
Происходит процесс перемещения электронов, который, по сути, и является электротоком.
При разряде аккумулятора (подключении нагрузки) губчатый свинец анода выделяет положительные двухвалентные ионы свинца в электролит. Избыточные электроны перемещаются по внешней замкнутой электрической цепи к катоду, где происходит восстановление четырехвалентных ионов свинца до двухвалентных.
При их соединении с отрицательными ионами серного остатка электролита, образуется сульфат свинца на обоих электродах.
Ионы кислорода от диоксида свинца катода и ионы водорода из электролита соединяются, образуя молекулы воды. Поэтому плотность электролита понижается.
При заряде происходят обратные реакции. Под воздействием внешнего напряжения ионы двухвалентного свинца положительного электрода отдают по два электрона и окисляются в четырехвалентные. Эти электроны движутся к аноду и нейтрализуют ионы двухвалентного свинца, восстанавливая губчатый свинец. На катоде, путем промежуточных реакций, снова образуется двуокись свинца.
На катоде, путем промежуточных реакций, снова образуется двуокись свинца.
Химические реакции в одной ячейке вырабатывают напряжение 2 В, поэтому на клеммах аккумулятора из 6 ячеек и получается 12 В.
Из видео Вы сможете более подробно узнать, как работает аккумулятор:
Читайте также, как правильно выбрать аккумулятор по емкости, особенности литий-ионных и никиль-кадмиевых аккмуляторов
Аккумуляторная батарея автомобиля — назначение, устройство и типы
Главная / Учебник по устройству автомобиля / Глава 10. Электрооборудование и электросистемы » Подраздел 10.2 Аккумуляторная батарея (АКБ). Назначение, устройство и типы
Назначение аккумуляторной батареи
Аккумуляторная батарея обеспечивает электрическим током все потребители, пока двигатель не работает или работает на очень малых оборотах, также является резервным источником питания в случае выхода из строя генератора.
Внимание
В случае выхода из строя генератора не стоит затягивать с его ремонтом, необходимо сразу решать возникшую проблему. Длительное использование исключительно АКБ может вывести ее из строя, причем в самый неподходящий момент.
Одним из основных функциональных назначений АКБ является пуск двигателя с помощью стартера.
Устройство аккумуляторной батареи
В аккумуляторной батарее происходит преобразование химической энергии в электрическую. Химия в том, что взяли и поместили в раствор серной кислоты две пластины, состоящие из свинца, и на пластинах сделали выводы (рисунок 10.1). Подсоединили к выводам два провода от генератора, начали вращать его, чтобы тот выделял электрический ток и зарядили АКБ (пока аккумулятор заряжается, он является потребителем тока). В данном случае электрическая энергия преобразовалась в химическую – аккумулятор зарядился. Отсоединили от выводов генератор и подсоединили, например, лампочку, и она загорелась! Потому что начался процесс преобразования химической энергии в электрическую.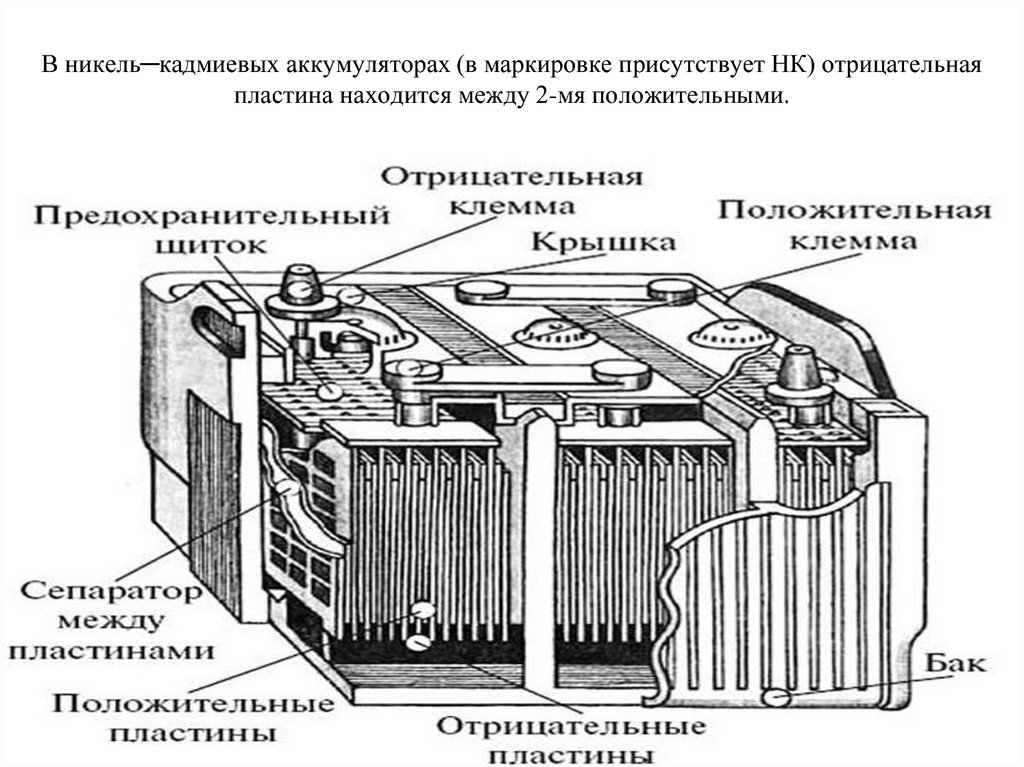 Прелесть данной конструкции в том, что процессы зарядки и разрядки можно производить многократно. И если соблюдать основные, довольно несложные, правила эксплуатации АКБ, она может прослужить долгое время.
Прелесть данной конструкции в том, что процессы зарядки и разрядки можно производить многократно. И если соблюдать основные, довольно несложные, правила эксплуатации АКБ, она может прослужить долгое время.
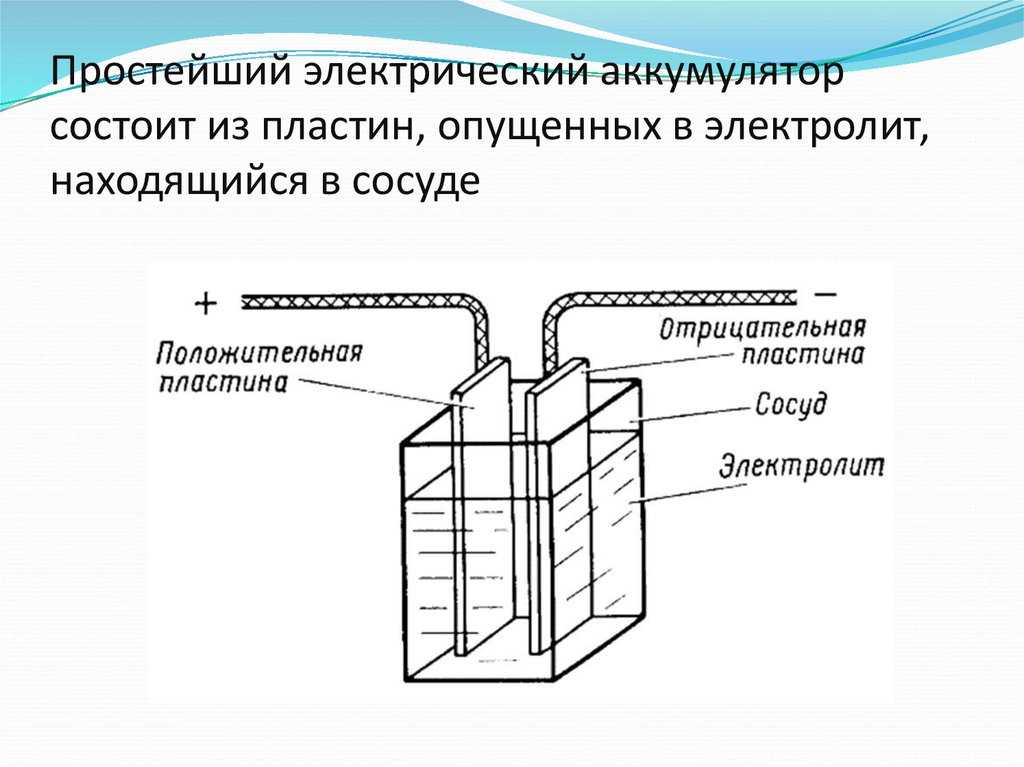
Простейший аккумулятор состоит из двух пластин, помещенных в корпус (его еще называют банкой), этот корпус заполнен раствором серной кислоты (который называется электролитом) и закрыт сверху крышкой. В крышке имеются отверстия, через которые выведены по два вывода от каждой из пластин (положительный и отрицательный).
Рисунок 10.1 Принцип работы аккумуляторной батареи.
Любая АКБ состоит из нескольких (чаще шести) простейших батарей, описанных выше. Почему именно шести? Бортовая сеть автомобиля рассчитана на 12 вольт, а значит и аккумуляторная батарея должна выдавать столько же. Ввиду своих габаритных размеров одна банка (две пластины) обеспечивает напряжение приблизительно в 2 вольта. Для получения 12 вольт положительные и отрицательные пластины соединяют последовательно и делают два общих вывода – положительный и отрицательный (смотрите рисунок 10. 2).
2).
Примечание
Аккумуляторная батарея должна иметь такие габаритные размеры, чтобы оптимально вписаться в ограниченное пространство моторного отсека автомобиля.
Рисунок 10.2 Устройство аккумуляторной батареи.
На многих современных автомобилях для предотвращения кражи головного модуля аудиосистемы существует своеобразная защита, которая блокирует аудиомагнитолу после отключения отрицательной клеммы от аккумуляторной батареи. Чтобы магнитола заработала, в нее необходимо ввести определенный код – ключ. Если вы приобретаете новый автомобиль, данный код вам вручат в салоне, если покупаете машину с рук, необходимо уточнить у владельца наличие такого кода.
Примечание
Стоит помнить, что в некоторых современных автомобилях после отключения АКБ и повторного подключения бортовой компьютер может вывести сообщение об ошибке, которое можно сбросить с помощью специализированного оборудования на СТО.
Типы АКБ
По принципу необходимости обслуживания аккумуляторные батареи разделяют на: обслуживаемые и необслуживаемые. Одним из подтипов обслуживаемых стали малообслуживаемые АКБ. На данный момент применение обслуживаемых АКБ сведено к минимуму. Названия типов аккумуляторных батарей говорят сами за себя.
Одним из подтипов обслуживаемых стали малообслуживаемые АКБ. На данный момент применение обслуживаемых АКБ сведено к минимуму. Названия типов аккумуляторных батарей говорят сами за себя.
Основа свинцово-кислотных АКБ, о которых идет речь в данной главе, — жидкий электролит. Однако технологии производства батарей шагнули далеко вперед и сейчас довольно часто можно встретить АКБ, выполненные на базе технологии AGM, в которой сам электролит абсорбирован в стеклянных волокнах. Также не стоит забывать и о набирающих популярность гелевых АКБ (GEL), в них электролит загущен с помощью силикагеля до гелеобразного состояния.
Из-за большого многообразия типов АКБ возникло много споров относительно эффективности и стойкости каждого из них. Если по существу, то нет одного, идеального для всех эксплуатационных условий аккумулятора. Ибо, выигрывая в чем-то одном, любой тип АКБ обязательно существенно проигрывает в чем-нибудь другом. Так, например, столь популярные необслуживаемые «кальциевые» аккумуляторы имеют очень низкие показатели саморазряда и не требуют к себе какого-либо внимания, однако они очень сильно «боятся» глубоких разрядов (как пример, при многократных коротких поездках в зимний период). С такими разрядами АКБ такого типа придет в непригодность за очень короткий период эксплуатации. А вот малообслуживаемые АКБ глубоких разрядов не боятся, но взамен требуют регулярной доливки дистиллированной воды (в среднем, раз в полгода).
С такими разрядами АКБ такого типа придет в непригодность за очень короткий период эксплуатации. А вот малообслуживаемые АКБ глубоких разрядов не боятся, но взамен требуют регулярной доливки дистиллированной воды (в среднем, раз в полгода).
Примечание
Во время зарядки АКБ происходит закипание электролита, но закипание не в бытовом понимании этого слова, просто происходит расщепление воды на кислород и водород (появляются пузырьки). Составная часть электролита – вода – выкипает, а плотность электролита, соответственно, растет. Чтобы привести плотность электролита в норму, доливают дистиллированную воду.
Внимание
Одной из существенных опасностей при плановой зарядке АКБ является выделение водорода из электролита. И вроде мало, но и взорваться может. Поэтому при обслуживании и эксплуатации АКБ необходимо соблюдать все меры предосторожности.
Основные характеристики АКБ
Полярность указывает на расположение отрицательного и положительного выводов батареи.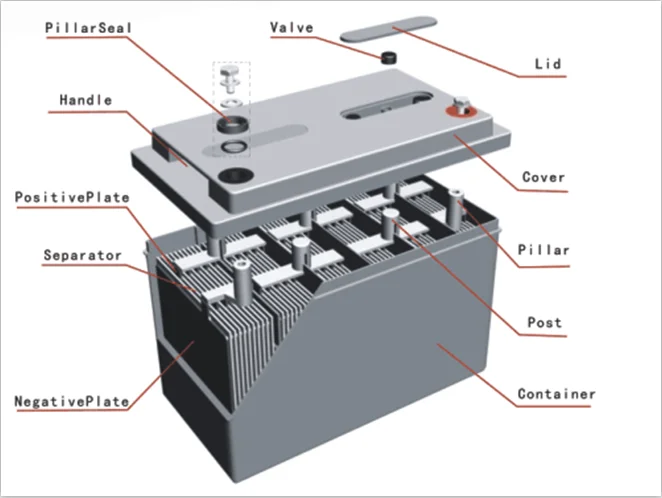 Полярность бывает прямой и обратной.
Полярность бывает прямой и обратной.
Примечание
Чтобы узнать, какая полярность на вашей АКБ, установите ее к себе той стороной, ближе к которой смещены выводы. Посмотрите, какой из выводов обозначен знаком «+», а какой — знаком «-». Если «+» находится слева, значит полярность прямая, если справа – обратная.
Номинальная емкость (обозначается С20) — количество электричества (в А·ч), которое способна отдать АКБ при 20-часовом режиме разряда током, численно равным 0,05 номинальной емкости до напряжения на выводах 10,5 В при температуре электролита 25 °С.
Внимание
Следует всегда помнить о том, что на автомобиль следует устанавливать АКБ той емкости, которая указана заводом-изготовителем транспортного средства. В принципе, ничего страшного не случится, и первое время будет радовать резвый пуск двигателя, но не стоит забывать о том, что возможности генератора не безграничны, а условия эксплуатации автомобиля могут быть очень суровы. Как следствие, батарея большей емкости будет постоянно недополучать энергию для восстановления — не будет заряжаться на 100%, что в скором времени приведет к выходу ее из строя.
Резервная емкость (обозначается Cр) – время разряда в минутах полностью заряженной батареи током 25 А до напряжения 10,5 В при температуре электролита 25 °С.
Примечание
Резервная емкость в 1,63 раза больше номинальной в числовом выражении (так, для АКБ емкостью 55 А·ч она составляет приблизительно 90 минут). Это время, в течение которого полностью заряженная батарея может обеспечивать электроэнергией минимальное количество потребителей, необходимых для безопасного движения автомобиля в случае отказа генератора.
Ток холодной прокрутки (Iх.п.) – по ГОСТу (ДСТУ) 959-2002 – это ток разряда, который способна отдать батарея при температуре электролита минус 18 °С в течение 10 секунд при напряжении не менее 7,5 В. Чем выше данный параметр, тем лучше двигатель будет пускаться зимой, однако по причине увеличения нагрузки на стартер может снизиться его ресурс.
Примечание
Величина тока холодной прокрутки зависит от методики ее измерения. Примерное соответствие значений тока холодной прокрутки, определенного по разным стандартам, приведено в таблице ниже.
Примерное соответствие значений тока холодной прокрутки, определенного по разным стандартам, приведено в таблице ниже.
| DIN 43559, ГОСТ 959-91 | 170 | 200 | 225 | 255 | 280 | 310 | 335 | 365 | 395 | 420 |
| EN 60095-1, ГОСТ 959-2002 (Россия) | 280 | 330 | 360 | 420 | 480 | 520 | 540 | 600 | 640 | 680 |
| SAE J537 | 300 | 350 | 400 | 450 | 500 | 550 | 600 | 650 | 700 | 750 |
Одним из основных показателей, характеризующих рабочее состояние АКБ, является плотность электролита. Она должна быть всегда в определенном диапазоне. Если АКБ малообслуживаемая, то летом плотность немного понижают, а вот зимой, чтобы исключить вероятность замерзания электролита, повышают.
Примечание
Плотность электролита измеряется специальным прибором – ареометром.
При покупке АКБ
Допустим, вы решили заменить источник питания. Придя, например, в магазин автозапчастей, определились с моделью. Теперь внимательнее. Спросите сначала АКБ сухозаряженный (без электролита) или залитый электролитом и заряженный. В первом случае срок хранения на складе не должен превышать трех лет, во втором – полугода.
Посмотрите на дату изготовления АКБ и если с даты производства прошло более одного года, выполните, по возможности, следующие проверки:
- осмотрите корпус на наличие повреждений;
Для залитых и заряженных
- уровень электролита должен находиться между метками «min» и «max» (корпус из полупрозрачного пластика) или быть выше примерно на 15 – 20 мм от верхнего торца пластин;
- плотность электролита должна составлять 1,25–1,26 г/см3 при 25±5 °С;
Маркировка АКБ
Рисунок 10.3 Маркировка АКБ по отечественному стандарту.
Рисунок 10.4 Маркировка АКБ по европейскому стандарту EN 60095-1.
Рисунок 10.5 Маркировка АКБ по американскому стандарту SAE J537.
Для всех
- цвет индикатора заряженности (если такой есть в наличии) должен быть зеленым;
- напряжение на выводах без нагрузки должно быть не менее 12,6 В.
Внимание
Так или иначе, но в наличии должна быть инструкция по эксплуатации на русском или украинском языке и гарантийный талон с указанными условиями гарантии.
Не стесняйтесь требовать от продавца выполнения описанных выше проверок, ведь автомобильная АКБ это не батарейка в плеер, и приобретается не на один месяц, причем от качества АКБ зависит работа всех электрических систем автомобиля.
Подраздел 10.1 Общие сведения | Система пуска. Стартер, его устройство и работа График технического обслуживания автомобиля | Подраздел 10.3 Обслуживание АКБ. Техника безопасности при обслуживании АКБ |
Please enable JavaScript to view the comments powered by Disqus.
comments powered by Disqus
Как работает батарея — Любопытно
Представьте себе мир без батареек. Все те портативные устройства, от которых мы так зависим, были бы такими ограниченными! Мы смогли бы донести наши ноутбуки и телефоны только до предела досягаемости их кабелей, что сделало бы это новое работающее приложение, которое вы только что загрузили на свой телефон, довольно бесполезным.
К счастью, у нас есть батарейки. Еще в 150 г. до н.э. в Месопотамии парфянская культура использовала устройство, известное как багдадская батарея, сделанное из медных и железных электродов с уксусом или лимонной кислотой. Археологи считают, что на самом деле это не были батареи, а использовались в основном для религиозных церемоний.
Изобретение батареи в том виде, в каком мы ее знаем, приписывают итальянскому ученому Алессандро Вольта, который собрал первую батарею, чтобы доказать точку зрения другого итальянского ученого, Луиджи Гальвани. В 1780 году Гальвани показал, что лапки лягушек, подвешенных на железных или латунных крючках, будут дергаться при прикосновении к ним зондом из какого-либо другого металла. Он считал, что это было вызвано электричеством из тканей лягушек, и называл это «животным электричеством».
В 1780 году Гальвани показал, что лапки лягушек, подвешенных на железных или латунных крючках, будут дергаться при прикосновении к ним зондом из какого-либо другого металла. Он считал, что это было вызвано электричеством из тканей лягушек, и называл это «животным электричеством».
Луиджи Гальвани обнаружил, что лапки лягушек, подвешенных на латунных крючках, дергались, если их проткнуть зондом из другого металла. Он думал, что эта реакция была вызвана «животным электричеством» внутри лягушки. Источник изображения: Луиджи Гальвани / Wikimedia Commons.
Вольта, поначалу впечатленный открытиями Гальвани, пришел к выводу, что электрический ток исходит из двух разных типов металла (крючков, на которых висят лягушки, и другого металла зонда) и просто передается через них, а не через них. из тканей лягушек. Он экспериментировал со стопками слоев серебра и цинка, перемежаемых слоями ткани или бумаги, пропитанными соленой водой, и обнаружил, что электрический ток действительно протекал по проводу, прикрепленному к обоим концам стопки.
Батарея Алессандро Вольта: груда цинковых и серебряных листов с вкраплениями ткани или бумаги, пропитанной соленой водой. Представьте, что вы используете это для питания вашего телефона. Источник изображения: Луиджи Кьеза / Wikimedia Commons.
Вольта также обнаружил, что, используя различные металлы в куче, можно увеличить величину напряжения. Он описал свои открытия в письме Джозефу Бэнксу, тогдашнему президенту Лондонского королевского общества, в 1800 году. ‘ (мера электрического потенциала) названа в его честь.
Я сам, если не считать шуток, поражаюсь тому, как мои старые и новые открытия… чистого и простого электричества, вызываемого контактом металлов, могли вызвать такой ажиотаж.Алессандро Вольта
Так что же именно происходило с этими слоями цинка и серебра и с дергающимися лягушачьими лапками?
Химия батареи
Батарея представляет собой устройство, которое накапливает химическую энергию и преобразует ее в электричество. Это известно как электрохимия, а система, которая лежит в основе батареи, называется электрохимической ячейкой. Батарея может состоять из одного или нескольких (как в исходной куче Вольты) электрохимических элементов. Каждая электрохимическая ячейка состоит из двух электродов, разделенных электролитом.
Это известно как электрохимия, а система, которая лежит в основе батареи, называется электрохимической ячейкой. Батарея может состоять из одного или нескольких (как в исходной куче Вольты) электрохимических элементов. Каждая электрохимическая ячейка состоит из двух электродов, разделенных электролитом.
Так откуда электрохимический элемент получает электричество? Чтобы ответить на этот вопрос, нам нужно знать, что такое электричество. Проще говоря, электричество — это тип энергии, производимый потоком электронов. В электрохимической ячейке электроны образуются в результате химической реакции, которая происходит на одном электроде (подробнее об электродах ниже!), а затем перетекают на другой электрод, где они расходуются. Чтобы понять это правильно, нам нужно поближе взглянуть на компоненты клетки и на то, как они собираются вместе.
Электроды
Чтобы создать поток электронов, вам нужно где-то, чтобы электроны текли из , и куда-то, чтобы электроны текли в . Это электроды клетки. Электроны текут от одного электрода, называемого анодом (или отрицательным электродом), к другому электроду, называемому катодом (положительный электрод). Как правило, это различные типы металлов или других химических соединений.
Это электроды клетки. Электроны текут от одного электрода, называемого анодом (или отрицательным электродом), к другому электроду, называемому катодом (положительный электрод). Как правило, это различные типы металлов или других химических соединений.
В батарее Вольта анодом был цинк, от которого электроны текли по проводу (при подключении) к серебру, которое было катодом батареи. Он сложил множество этих элементов вместе, чтобы сделать общую кучу и поднять напряжение.
Но откуда анод получает все эти электроны? И почему они так счастливы, что их весело отправляют на катод? Все сводится к химии, которая происходит внутри клетки.
Происходит несколько химических реакций, которые нам нужно понять. На аноде электрод вступает в реакцию с электролитом, в результате которой образуются электроны. Эти электроны накапливаются на аноде. Тем временем на катоде одновременно происходит другая химическая реакция, которая позволяет этому электроду принимать электроны.
Технический химический термин для реакции, включающей обмен электронами, представляет собой реакцию восстановления-окисления, чаще называемую окислительно-восстановительной реакцией. Всю реакцию можно разделить на две полуреакции, а в случае электрохимической ячейки одна полуреакция происходит на аноде, другая на катоде. Восстановление — это присоединение электронов, и это то, что происходит на катоде; мы говорим, что катод восстанавливается в ходе реакции. Окисление — это потеря электронов, поэтому мы говорим, что анод окисляется.
Всю реакцию можно разделить на две полуреакции, а в случае электрохимической ячейки одна полуреакция происходит на аноде, другая на катоде. Восстановление — это присоединение электронов, и это то, что происходит на катоде; мы говорим, что катод восстанавливается в ходе реакции. Окисление — это потеря электронов, поэтому мы говорим, что анод окисляется.
Каждая из этих реакций имеет определенный стандартный потенциал. Думайте об этой характеристике как о способности/эффективности реакции либо производить, либо поглощать электроны — ее сила в перетягивании каната электронами.
- Стандартные потенциалы для полуреакций
Ниже приведен список полуреакций, которые включают высвобождение электронов либо из чистого элемента, либо из химического соединения. Рядом с реакцией указано число (E 0 ), которое сравнивает силу электрохимического потенциала реакции с силой готовности водорода расстаться со своим электроном (если вы посмотрите вниз по списку, вы увидите, что водородная полуреакция имеет Е 0 нуля).
 E 0 измеряется в вольтах.
E 0 измеряется в вольтах.Причина, по которой этот список настолько интересен, заключается в том, что если вы выберете две реакции из списка и объедините их для создания электрохимической ячейки, значения E 0 подскажут вам, каким образом будет протекать общая реакция: реакция с более отрицательное значение E 0 пожертвует свои электроны другой реакции, и это определяет анод и катод вашей ячейки. Разница между двумя значениями E 0 говорит вам об электрохимическом потенциале вашей ячейки, который в основном является напряжением ячейки.
Итак, если вы возьмете литий и фтор и сумеете соединить их, чтобы сделать элемент батареи, вы получите максимальное напряжение, теоретически достижимое для гальванического элемента. Этот список также объясняет, почему в куче Вольта цинк был анодом, а серебро катодом: полуреакция цинка имеет более низкое (более отрицательное) значение E 0 (-0,7618), чем полуреакция серебра (0,7996).
 .
.Стандартные потенциалы полуреакций восстановления
(по отношению к стандартному водородному электроду при 25°C)
В° (В) Li + (водный) + e − Li(s) –3,040 Be 2+ (водн.) + 2e − Be(s) –1,99 Al 3+ (водн.) + 3e − Al(s) –1,676 Zn 2+ (водный) + 2e − Zn(s) –0,7618 Ag 2 S(s) + 2e − 2Ag(s) + S 2− (водн.) –0,71 Fe 2+ (водн.) + 2e − Fe(s) –0,44 Cr 3+ (водн.) + e − Cr 2+ (водн.) –0,424 Cd 2+ (водн.) + 2e − Cd(s) –0,4030 PbSO 4 (т) + 2e − Pb(т) + SO 4 2− (водн.  )
)–0,356 Ni 2+ (водн.) + 2e − Ni(s) –0,257 2SO 4 2− (водн.) + 4H + (водн.) + 2e − S 2 O 6 − 290940048 (водн.) + 2H 2 O(л) –0,25 Sn 2+ (водн.) + 2e − Sn(s) −0,14 2H + (водн.) + 2e − H 2 (г) 0 Sn 4+ (водн.) + 2e − Sn 2+ (водн.) 0,154 Cu 2+ (водн.) + e − Cu + (водный) 0,159 AgCl(s) + e − Ag(s) + Cl − (водн.) 0,2223 Cu 2+ (водн.) + 2e − Cu(s) 0,3419 O 2 (г) + 2H 2 O(ж) + 4e − 4OH − (водн.  )
)0,401 H 2 SO 3 (водн.) + 4H + (водн.) + 4e − S(т) + 3H 2 O(л) 0,45 I 2 (s) + 2e − 2I − (aq) 0,5355 MnO 4 2− (водн.) + 2H 2 O(ж) + 2e − MnO 2 (тв) + 4OH − 906 0,6 O 2 (г) + 2H + (водн.) + 2e − H 2 O 2 (водный) 0,695 H 2 SeO 3 (водн.) + 4H + + 4e − Se(s) + 3H 2 O(ж) 0,74 Fe 3+ (водн.) + e − Fe 2+ (водн.) 0,771 Ag + (водный) + e − Ag(s) 0,7996 NO 3 − (водн.  ) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l)
) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l)0,94 Br 2 (водн.) + 2e − 2Br − (водн.) 1,087 MnO 2 (т) + 4H + (водн.) + 2e − Mn 2+ (водн.) + 2H 2 O(л) 1,23 О 2 (г) + 4H + (водн.) + 4e − 2H 2 O(л) 1,229 Cr 2 O 7 2- (водн.) + 14H + (водн.) + 6e — 2Cr 3+ 9048 (водн.) 123 О(л) 1,36 Cl 2 (г) + 2e − 2Cl − (водн.) 1,396 Се 4+ (водн.)+е − Се 3+ (водный) 1,44 PbO 2 (тв) + HSO 4 − (водн.  ) + 3H + (водн.) + 2e − PbSO 2 2 (2) () 0123 О(л)
) + 3H + (водн.) + 2e − PbSO 2 2 (2) () 0123 О(л)1,69 H 2 O 2 (водн.) + 2H + (водн.) + 2e − 2H 2 O(л) 1,763 F 2 (г) + 2e − 2F − (водный) 2,87 Источник: UC Davis ChemWiki
Любые два проводящих материала, вступающих в реакции с разными стандартными потенциалами, могут образовать электрохимическую ячейку, потому что более сильный сможет отбирать электроны у более слабого. Но идеальным выбором для анода был бы материал, который вызывает реакцию со значительно более низким (более отрицательным) стандартным потенциалом, чем материал, который вы выбрали для своего катода. В итоге мы получаем, что электроны притягиваются к катоду от анода (и анод не пытается сильно сопротивляться), и когда у нас есть легкий путь туда — проводящий провод — мы можем использовать их энергию для обеспечения электрического тока. питание на фонарик, телефон или что-то еще.
питание на фонарик, телефон или что-то еще.
Разница в стандартном потенциале между электродами примерно равна силе, с которой электроны перемещаются между двумя электродами. Это известно как общий электрохимический потенциал ячейки, и он определяет напряжение ячейки. Чем больше разница, тем больше электрохимический потенциал и выше напряжение.
Чтобы увеличить напряжение батареи, у нас есть два варианта. Мы могли бы выбрать разные материалы для наших электродов, которые придадут клетке больший электрохимический потенциал. Или мы можем сложить несколько ячеек вместе. Когда элементы объединены определенным образом (последовательно), это оказывает аддитивное влияние на напряжение батареи. По сути, силу, с которой электроны движутся через батарею, можно рассматривать как общую силу, когда они движутся от анода первой ячейки через все ячейки, содержащиеся в батарее, к катоду последней ячейки.
Когда ячейки объединены другим способом (параллельно), это увеличивает возможный ток батареи, который можно рассматривать как общее количество электронов, протекающих через ячейки, но не как их напряжение.
Электролит
Но электроды — это только часть батареи. Помните бумажки Вольта, смоченные в соленой воде? Соленая вода была электролитом, еще одной важной частью картины. Электролит может быть жидкостью, гелем или твердым веществом, но он должен обеспечивать движение заряженных ионов.
Электроны имеют отрицательный заряд, и, поскольку мы посылаем поток отрицательных электронов по нашей цепи, нам нужен способ сбалансировать движение этого заряда. Электролит обеспечивает среду, через которую могут протекать положительные ионы, уравновешивающие заряд.
Поскольку химическая реакция на аноде приводит к образованию электронов, для поддержания баланса нейтрального заряда на электроде также производится соответствующее количество положительно заряженных ионов. Они не идут по внешнему проводу (это только для электронов!), а выбрасываются в электролит.
В то же время катод также должен уравновешивать отрицательный заряд электронов, которые он получает, поэтому происходящая здесь реакция должна втягивать положительно заряженные ионы из электролита (в качестве альтернативы она может также высвобождать отрицательно заряженные ионы из электрода в электролит).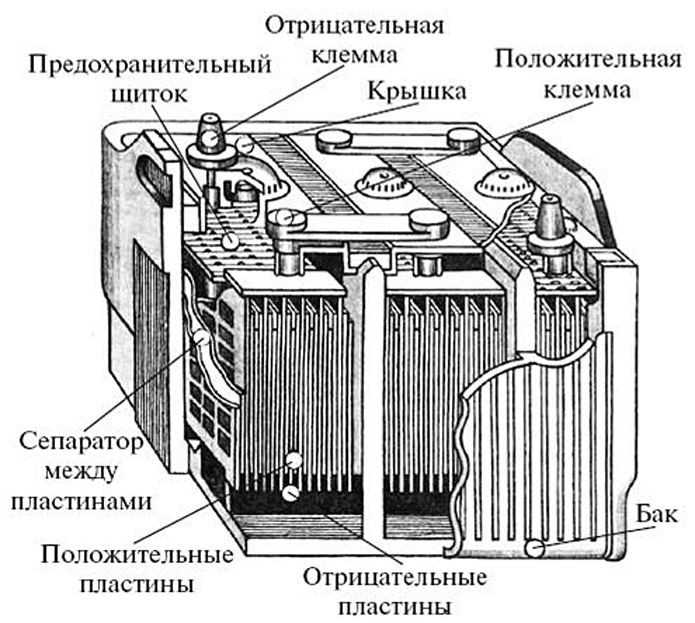
Таким образом, в то время как внешний провод обеспечивает путь для потока отрицательно заряженных электронов, электролит обеспечивает путь для передачи положительно заряженных ионов, чтобы сбалансировать отрицательный поток. Этот поток положительно заряженных ионов столь же важен, как и электроны, обеспечивающие электрический ток во внешней цепи, которую мы используем для питания наших устройств. Роль балансировки заряда, которую они выполняют, необходима для поддержания всей реакции.
Теперь, если позволить всем ионам, выпущенным в электролит, полностью свободно перемещаться через электролит, они закончат тем, что покроют поверхности электродов и засорят всю систему. Таким образом, у клетки обычно есть какой-то барьер, чтобы предотвратить это.
Показывать метки во время анимации
Начать анимацию
При использовании батареи возникает ситуация, при которой происходит непрерывный поток электронов (через внешнюю цепь) и положительно заряженных ионов (через электролит). Если этот непрерывный поток остановлен — если цепь разомкнута, например, когда ваш фонарик выключен — поток электронов остановится. Заряды будут накапливаться, и химические реакции, управляющие батареей, прекратятся.
Если этот непрерывный поток остановлен — если цепь разомкнута, например, когда ваш фонарик выключен — поток электронов остановится. Заряды будут накапливаться, и химические реакции, управляющие батареей, прекратятся.
По мере использования батареи и протекания реакций на обоих электродах производятся новые химические продукты. Эти продукты реакции могут создать своего рода сопротивление, которое может помешать протеканию реакции с той же эффективностью. Когда это сопротивление становится слишком большим, реакция замедляется. Электронное перетягивание каната между катодом и анодом также теряет свою силу, и поток электронов прекращается. Аккумулятор медленно садится.
Зарядка аккумулятора
Некоторые распространенные батареи предназначены только для одноразового использования (известные как первичные или одноразовые батареи). Путешествие электронов от анода к катоду является односторонним. Либо их электроды истощаются, когда они выделяют свои положительные или отрицательные ионы в электролит, либо накопление продуктов реакции на электродах препятствует продолжению реакции, и дело сделано и запылено. Аккумулятор попадает в мусорное ведро (или, надеюсь, на переработку, но это совсем другая тема Nova).
Аккумулятор попадает в мусорное ведро (или, надеюсь, на переработку, но это совсем другая тема Nova).
Но. Преимущество этого потока ионов и электронов в том, что он имеет место в некоторых типах батарей с соответствующими материалами электродов, заключается в том, что он также может двигаться в обратном направлении, возвращая нашу батарею в исходную точку и давая ей совершенно новую жизнь. . Точно так же, как батареи изменили то, как мы можем использовать различные электрические устройства, перезаряжаемые батареи еще больше изменили полезность и срок службы этих устройств.
Когда мы подключаем почти разряженную батарею к внешнему источнику электроэнергии и отправляем энергию обратно в батарею, она обращает вспять химическую реакцию, которая произошла во время разряда. Это отправляет положительные ионы, выпущенные из анода в электролит, обратно к аноду, а электроны, которые принял катод, также возвращаются к аноду. Возвращение как положительных ионов, так и электронов обратно в анод запускает систему, поэтому она снова готова к работе: ваша батарея перезаряжена.
Показывать метки во время анимации
Начать анимацию
Однако процесс не идеален. Замена отрицательных и положительных ионов из электролита обратно на соответствующий электрод по мере перезарядки батареи происходит не так аккуратно и красиво, как электрод изначально. Каждый цикл зарядки ухудшает состояние электродов еще немного, а это означает, что батарея со временем теряет производительность, поэтому даже перезаряжаемые батареи не могут работать вечно.
В течение нескольких циклов зарядки и разрядки форма кристаллов батареи становится менее упорядоченной. Это усугубляется, когда батарея разряжается/перезаряжается с высокой скоростью, например, если вы едете на своем электромобиле большими рывками, а не постоянно. Циклирование с высокой скоростью приводит к тому, что кристаллическая структура становится более неупорядоченной, в результате чего батарея становится менее эффективной.
Эффект памяти и саморазряд
Почти полностью обратимые реакции разрядки и перезарядки также способствуют так называемому «эффекту памяти».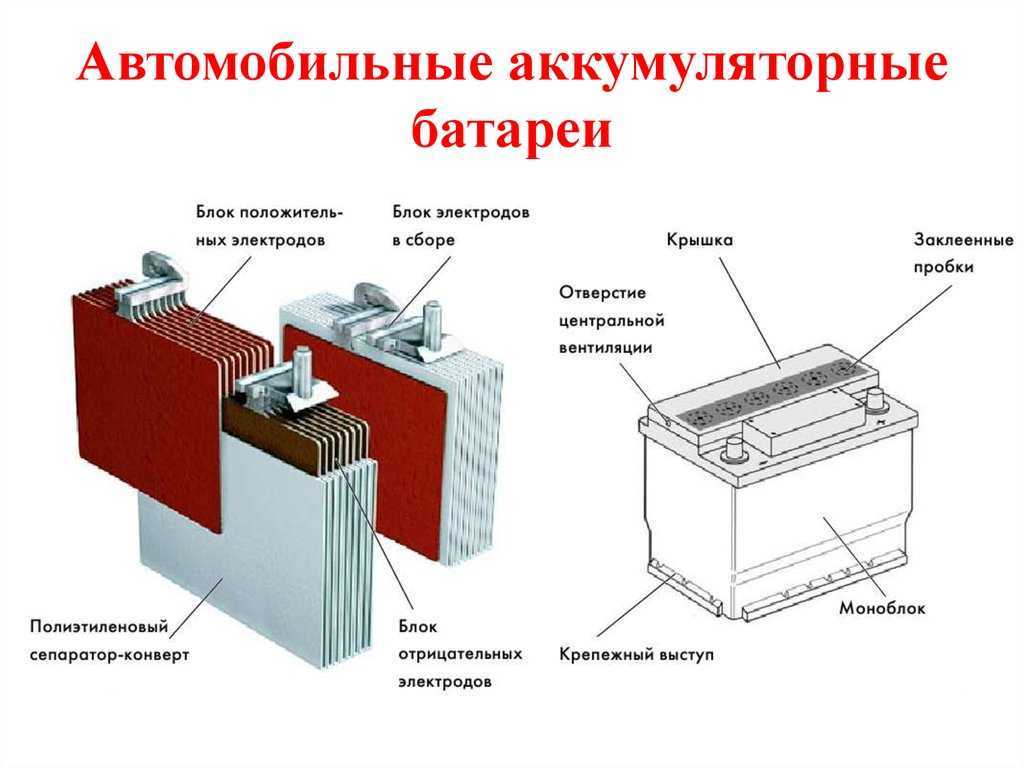 Когда вы перезаряжаете некоторые типы перезаряжаемых батарей, предварительно не разрядив их в достаточной степени, они «вспоминают», на каком уровне они были в предыдущих циклах разрядки, и не заряжаются должным образом.
Когда вы перезаряжаете некоторые типы перезаряжаемых батарей, предварительно не разрядив их в достаточной степени, они «вспоминают», на каком уровне они были в предыдущих циклах разрядки, и не заряжаются должным образом.
В некоторых элементах это вызвано тем, как металл и электролит реагируют с образованием соли (и тем, как соль затем снова растворяется, а металл заменяется на электродах при перезарядке). Мы хотим, чтобы наши клетки имели красивые, однородные маленькие кристаллы соли, покрывающие идеальную металлическую поверхность, но это не то, что мы получаем в реальном мире! Способ формирования некоторых кристаллов очень сложен, и способ осаждения некоторых металлов во время перезарядки также удивительно сложен, поэтому некоторые типы батарей имеют больший эффект памяти, чем другие. Несовершенства в основном зависят от состояния заряда батареи, температуры, зарядного напряжения и зарядного тока. Со временем недостатки в одном цикле зарядки могут вызвать то же самое в следующем цикле зарядки и т. д., и наша батарея накапливает некоторые плохие воспоминания. Эффект памяти силен для некоторых типов элементов, таких как батареи на основе никеля. Другие типы, такие как литий-ионные, не страдают от этой проблемы.
д., и наша батарея накапливает некоторые плохие воспоминания. Эффект памяти силен для некоторых типов элементов, таких как батареи на основе никеля. Другие типы, такие как литий-ионные, не страдают от этой проблемы.
Еще один аспект перезаряжаемых батарей заключается в том, что химический состав, делающий их перезаряжаемыми, также означает, что они имеют более высокую склонность к саморазряду. Это когда внутри элемента батареи происходят внутренние реакции, даже когда электроды не подключены через внешнюю цепь. Это приводит к тому, что клетка со временем теряет часть своей химической энергии. Высокая скорость саморазряда серьезно ограничивает срок службы батареи и заставляет ее умирать при хранении.
Литий-ионные аккумуляторы в наших мобильных телефонах имеют довольно хорошую скорость саморазряда, около 2–3 % в месяц, и наши свинцово-кислотные автомобильные аккумуляторы также довольно разумны — они имеют тенденцию терять 4–6 %. в месяц. Аккумуляторы на основе никеля теряют около 10–15 процентов своего заряда в месяц, что не очень хорошо, если вы планируете хранить фонарь целый сезон, когда он вам не нужен! Неперезаряжаемая щелочная батарея теряет всего около 2–3 процентов своего заряда в год.
Напряжение, ток, мощность, мощность… в чем разница?
Все эти слова в основном описывают мощность батареи, верно? Ну вроде. Но все они немного разные.
Напряжение = сила, при которой реакция, приводящая в движение батарею, проталкивает электроны через ячейку. Это также известно как электрический потенциал и зависит от разности потенциалов между реакциями, происходящими на каждом из электродов, то есть от того, насколько сильно катод будет тянуть электроны (через цепь) от анода. Чем выше напряжение, тем большую работу может совершить одно и то же число электронов.
Ток = количество электронов, проходящих через любую точку цепи в данный момент времени. Чем больше сила тока, тем больше работы он может совершить при том же напряжении. Внутри ячейки вы также можете думать о токе как о количестве ионов, движущихся через электролит, умноженном на заряд этих ионов.
Мощность = напряжение x ток. Чем выше мощность, тем выше скорость, с которой батарея может работать — это соотношение показывает, насколько важны напряжение и ток для определения того, для чего подходит батарея.
Емкость = мощность батареи как функция времени, которая используется для описания периода времени, в течение которого батарея сможет питать устройство. Аккумулятор большой емкости сможет работать в течение более длительного периода, прежде чем разрядится или разрядится. У некоторых аккумуляторов есть небольшая грустная особенность: если вы попытаетесь извлечь из них слишком много слишком быстро, вовлеченные химические реакции не смогут продолжаться, и емкость уменьшится! Таким образом, мы всегда должны быть осторожны, когда говорим о емкости батареи и помнить, для чего она будет использоваться.
Другой популярный термин — «плотность энергии». Это количество энергии, которое устройство может удерживать на единицу объема, другими словами, какую отдачу вы получаете за свои деньги с точки зрения мощности и размера. С аккумулятором, как правило, чем выше плотность энергии, тем лучше, так как это означает, что аккумулятор может быть меньше и компактнее, что всегда является плюсом, когда он нужен для питания чего-то, что вы хотите держать в кармане. Для электромобилей это даже плюс — аккумулятор должен как-то влезать в машину!
Для электромобилей это даже плюс — аккумулятор должен как-то влезать в машину!
Для некоторых приложений, таких как хранение электроэнергии на возобновляемой электростанции, такой как ветряная или солнечная электростанция, высокая плотность энергии не является большой проблемой, так как у них, скорее всего, будет достаточно места для хранения батарей. Основной целью такого использования было бы просто хранить как можно больше электроэнергии, как можно безопаснее и дешевле.
Видео: Как работают аккумуляторы? (TED-Ed/YouTube). Посмотреть подробности и расшифровку.
Почему так много типов?
Ряд материалов (раньше это были просто металлы) можно использовать в качестве электродов в батарее. За прошедшие годы было опробовано много-много различных комбинаций, но лишь немногие из них действительно прошли дистанцию. Но зачем вообще использовать разные комбинации металлов? Если у вас есть пара металлов, которые хорошо работают вместе в качестве электродов, зачем возиться с другими?
Различные материалы имеют разные электрохимические свойства, поэтому они дают разные результаты, когда вы кладете их вместе в элемент батареи.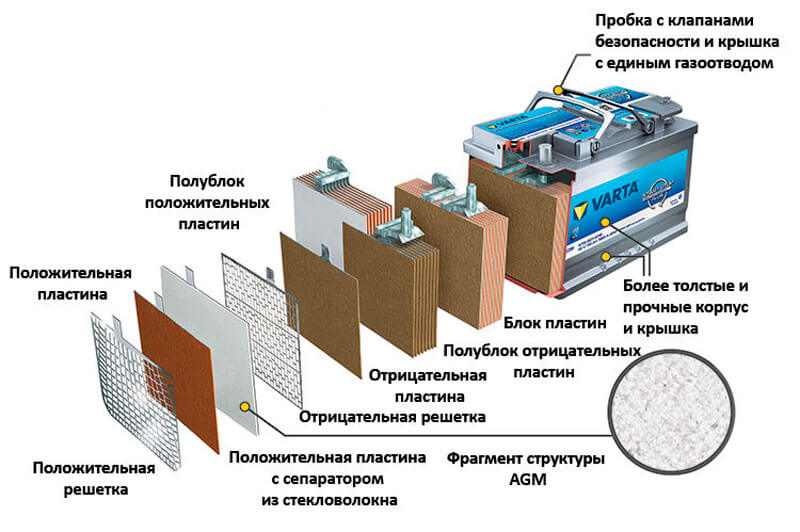 Например, некоторые комбинации будут создавать высокое напряжение очень быстро, но затем быстро падать, не в состоянии поддерживать это напряжение в течение длительного времени. Это хорошо, если вам нужно произвести, скажем, внезапную вспышку света, как вспышка фотокамеры.
Например, некоторые комбинации будут создавать высокое напряжение очень быстро, но затем быстро падать, не в состоянии поддерживать это напряжение в течение длительного времени. Это хорошо, если вам нужно произвести, скажем, внезапную вспышку света, как вспышка фотокамеры.
Другие комбинации дадут лишь струйку тока, но они будут поддерживать эту струйку на века. Например, нам не нужно большое количество тока для питания детектора дыма, но мы хотим, чтобы наши детекторы дыма работали долгое время.
Еще одна причина для использования различных комбинаций металлов заключается в том, что часто для получения требуемого напряжения необходимо сложить два или более элемента батареи, и оказывается, что некоторые комбинации электродов складываются вместе гораздо лучше, чем другие комбинации. Например, литий-железо-фосфатные батареи (разновидность литий-ионных батарей), используемые в электромобилях, объединяются вместе для создания систем высокого напряжения (100 и даже более вольт), но вы никогда не сделаете этого с теми никель-кадмиевыми батареями Walkman, которые получают горячий!
Наши различные потребности со временем привели к разработке огромного количества типов батарей. Чтобы узнать больше о них и о том, что ждет аккумулятор в будущем, ознакомьтесь с другими нашими темами Nova.
Чтобы узнать больше о них и о том, что ждет аккумулятор в будущем, ознакомьтесь с другими нашими темами Nova.
Эта тема является частью нашей серии статей о батареях, состоящей из четырех частей. Для дальнейшего чтения см. Типы аккумуляторов, литий-ионные аккумуляторы и аккумуляторы будущего.
Как работает батарея?
Энергия не может быть создана или уничтожена, но ее можно сохранить в различных формах. Один из способов его хранения — в виде химической энергии в батарее. При подключении к цепи батарея может производить электричество.
Батареи преобразуют химическую энергию в электрическую |
Батарея имеет два вывода: положительный (катод) и отрицательный (анод). Если вы соедините две клеммы проводом, образуется цепь. Электроны будут течь по проводу, и будет производиться электрический ток. Внутри батареи происходит реакция между химическими веществами.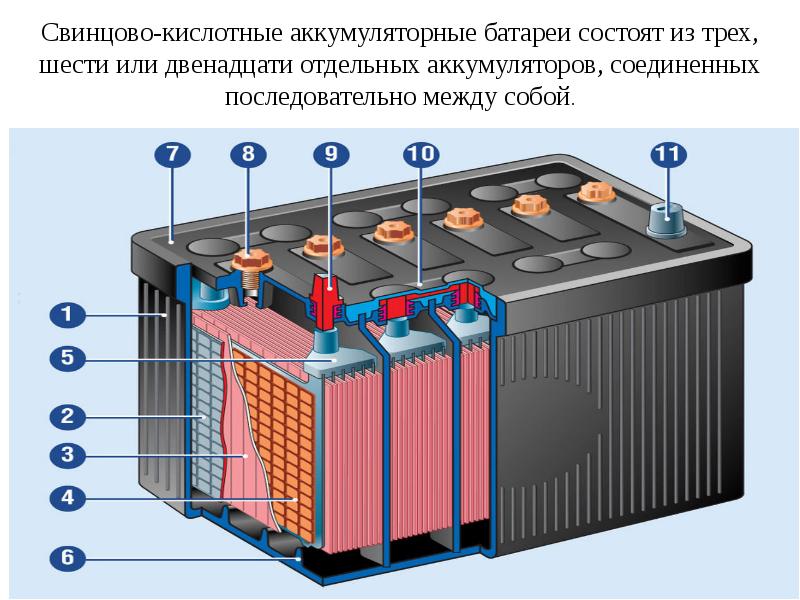 Но реакция происходит только при наличии потока электронов. Батареи могут храниться в течение длительного времени и продолжать работать, потому что химический процесс не начнется, пока электроны не перейдут от отрицательного к положительному выводу через цепь.
Но реакция происходит только при наличии потока электронов. Батареи могут храниться в течение длительного времени и продолжать работать, потому что химический процесс не начнется, пока электроны не перейдут от отрицательного к положительному выводу через цепь.
В батарее происходит химическая реакция
Простой пример. Батарея из лимонных элементов
Начнем с очень простой батареи, в которой используется лимон, в который вставлены два разных металлических предмета, например. оцинкованный гвоздь и медная монета или проволока. Медь служит положительным электродом или катодом, а гальванизированный (оцинкованный) гвоздь — отрицательным электродом или анодом, производящим электроны. Эти два объекта работают как электроды, вызывая электрохимическую реакцию, которая создает небольшую разность потенциалов.
Поскольку атомы меди (Cu) притягивают электроны больше, чем атомы цинка (Zn), если вы поместите кусок меди и кусок цинка в контакт друг с другом, электроны перейдут от цинка к меди. Когда электроны концентрируются на меди, они будут отталкиваться друг от друга и останавливать поток электронов от цинка к меди. С другой стороны, если вы поместите полоски цинка и меди в проводящий раствор и соедините их снаружи проводом, реакции между электродами и раствором позволят электронам непрерывно течь по проводу.
Когда электроны концентрируются на меди, они будут отталкиваться друг от друга и останавливать поток электронов от цинка к меди. С другой стороны, если вы поместите полоски цинка и меди в проводящий раствор и соедините их снаружи проводом, реакции между электродами и раствором позволят электронам непрерывно течь по проводу.
ЛИМОННАЯ БАТАРЕЯ | Как работает лимонная батарейка? Лимонная батарея состоит из лимона и двух металлических электродов из разных металлов, таких как медная монета или проволока, и оцинкованного (оцинкованного) гвоздя. Энергия для батареи исходит не от лимона, а от химического превращения цинка (или другого металла). Цинк окисляется внутри лимона, обменивая часть своих электронов, чтобы достичь более низкого энергетического состояния, а высвобождаемая энергия обеспечивает энергию. Если предположить, что используются цинковые и медные электроды (например, медная монета и оцинкованный гвоздь), то один лимон может генерировать примерно 0,9 Вольт. Слева последовательная цепь лимонов показывает, что вырабатывается 3,41 вольта. ПРИМЕЧАНИЕ: Можно использовать картофель, яблоки, квашеную капусту или любые другие фрукты или овощи, содержащие кислоту или другой электролит, но лимоны предпочтительнее из-за их более высокой кислотности. Например, в картофеле электролитом является фосфорная кислота, а в лимонах — лимонная кислота. |
В лимонной батарее происходит как окисление (потеря электронов), так и восстановление (приобретение электронов). Эта батарея похожа на оригинальные «простые гальванические элементы», изобретенные Алессандро Вольта (см.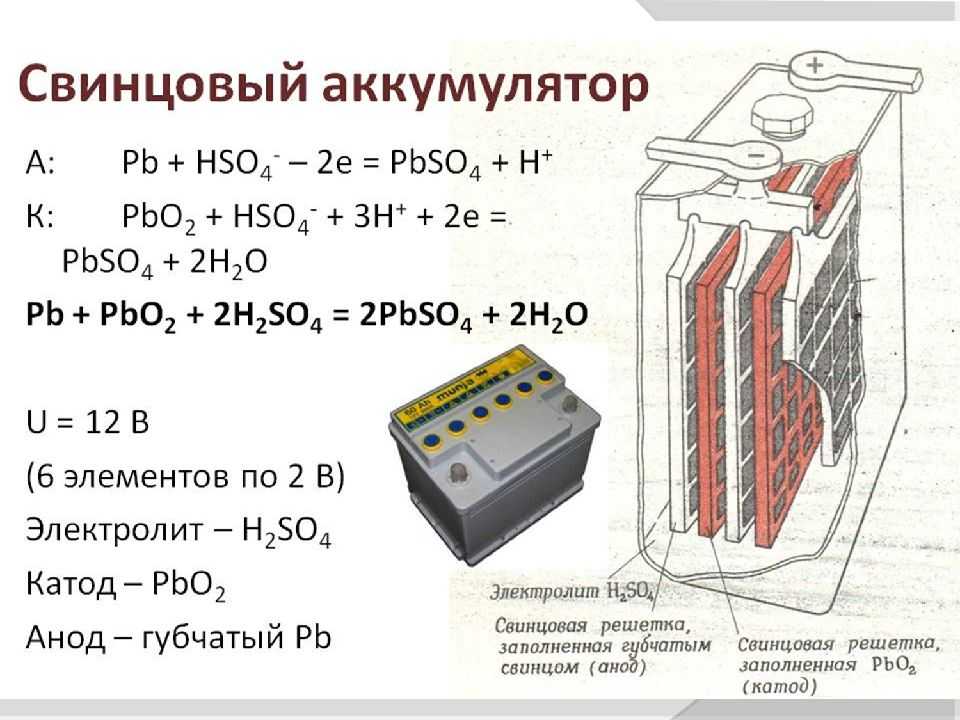 Ниже). На аноде металлический цинк окисляется и переходит в кислый раствор в виде ионов Zn2+:
Ниже). На аноде металлический цинк окисляется и переходит в кислый раствор в виде ионов Zn2+:
Zn —> Zn2 + + 2 e-
На медном катоде ионы водорода (сольватированные протоны из кислого раствора в лимоне) восстанавливаются с образованием молекулярного водорода:
2H++ 2e—> h3
Что заставляет электроны двигаться?
Когда вы отпускаете мяч, который держите в руках, он падает на землю, потому что гравитационное поле Земли тянет мяч вниз. Точно так же заряженные частицы, такие как электроны, должны совершить работу, чтобы переместиться из одной точки в другую. Количество работы на единицу заряда называется разностью электрических потенциалов между двумя точками. Единица разности потенциалов называется вольт.
Разность потенциалов между катодом и анодом определяется химической реакцией. Внутри батареи электроны подталкиваются химической реакцией к положительному концу, создавая разность потенциалов.
Именно эта разность потенциалов заставляет электроны двигаться по проводу.
Разность потенциалов может быть положительной или отрицательной, подобно гравитационной энергии, движущейся вверх или вниз по склону. В батарее поток электронов направлен вниз… электроны могут течь вверх, как в случае с зарядным устройством.
Почему внутри батареи электроны не перемещаются от анода к катоду?
Электролит в батарее не дает одиноким электронам двигаться прямо от анода к катоду внутри батареи. Когда клеммы соединены токопроводящим проводом, электроны могут легко течь от анода к катоду.
В каком направлении движутся электроны в проводе?
Электроны заряжены отрицательно, поэтому они будут притягиваться к положительному концу батареи и отталкиваться от отрицательного конца. Когда батарея подключена к устройству, которое позволяет электронам течь через нее, они текут от отрицательного (анодного) к положительному (катодному) выводу.
Кто изобрел гальванический элемент (батарейку)?
ПЕРВАЯ БАТАРЕЯ VOLTA | Аккумулятор производства Volta считается первым гальваническим элементом. Теперь у нас есть две клеммы, и ток будет течь, если мы их соединим. Реакции в этой ячейке следующие: цинк Zn —> Zn2+ + 2e- серная кислота 2H+ + 2e- —> h3 Медь не вступает в реакцию, действуя как электрод для химической реакции. |
Как работает современный аккумулятор (угольно-цинковый аккумулятор)?
Сухой угольно-цинковый элемент или батарея упакованы в цинковую банку, которая служит как контейнером, так и отрицательной клеммой (анодом). Цинк окисляется в соответствии со следующим полууравнением. Диоксид марганца смешивают с угольным порошком для увеличения электропроводности. Реакция выглядит следующим образом: 2MnO2(т) + 2 e- + 2Nh5Cl(водн.) —> , а CL сочетается с Zn2+. В этой полуреакции марганец восстанавливается из степени окисления (+4) в (+3). Zn(тв) + 2MnO2(тв) + 2Nh5Cl(вод) —> Mn2O3(тв) + Zn(Nh4)2Cl2 (вод) + h3O(ж) Аккумулятор имеет Э.Д.С. около 1,5 В. |
Какие существуют типы батарей?
В разных типах батарей используются разные типы химикатов и химических реакций. Некоторые из наиболее распространенных типов батарей:
Щелочные батареи | Используется в батареях Duracell® и Energizer® и других щелочных батареях. Электроды цинково-марганцево-оксидные. Электролит представляет собой щелочную пасту. |
Свинцово-кислотный аккумулятор | Используются в автомобилях. Электроды изготовлены из свинца и оксида свинца с сильной кислотой в качестве электролита. Электроды изготовлены из свинца и оксида свинца с сильной кислотой в качестве электролита. |
Литиевая батарея | Эти батарейки используются в фотоаппаратах для вспышки. Они изготавливаются из лития, йодида лития и йодида свинца. Они могут обеспечить скачки электричества для вспышки. |
| Литиевая батарея | Эти батарейки используются в фотоаппаратах для вспышки. Они изготавливаются из лития, йодида лития и йодида свинца. Они могут обеспечить скачки электричества для вспышки. |
| Литий-ионный аккумулятор | Эти батареи используются в портативных компьютерах, сотовых телефонах и другом портативном оборудовании с интенсивным использованием. |
| Никель-кадмиевая или никель-кадмиевая батарея | Электроды никель-гидроксидно-кадмиевые. Электролит – гидроксид калия. |
| Цинк-угольная батарея или стандартная угольная батарея – | Цинк и углерод используются во всех обычных или стандартных сухих батареях AA, C и D. Электроды изготовлены из цинка и углерода, а паста из кислотных материалов между ними служит электролитом. |
ССЫЛКИ И ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Potato Power: Руководство для учителя
История батареи
Электрохимические реакции
Углеродно-цинковая батарея
Как работают батареи Анимированное руководство по науке о батареях
Оценка
Вопросы:
М многократный
Выбор вопросов
1. В
В
аккумулятор плюсовая клемма называется:
а) анод
б) катод
в) электролит
г) провод
2.
Что заставляет электроны течь по проводу:
а) гравитационный потенциал выталкивает электроны через провод
б) кислоты проталкивают электроны по проводу
в) разность потенциалов между анодом и катодом толкает электроны
через провод
г) электроны текут не по проводу, а по электролиту
3.
Какое утверждение о лимонной батарейке верно?
а) Энергия для батареи исходит не от лимона, а
скорее химическое изменение цинка (или другого металла)
б) Батарея состоит из двух металлических электродов разной
металлы, такие как медная монета или проволока и оцинкованный гвоздь.
 E 0 измеряется в вольтах.
E 0 измеряется в вольтах. .
. )
) )
) ) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l)
) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l) ) + 3H + (водн.) + 2e − PbSO 2 2 (2) () 0123 О(л)
) + 3H + (водн.) + 2e − PbSO 2 2 (2) () 0123 О(л) Лимон просто обеспечивает среду, в которой это может произойти, но они не расходуются в процессе.
Лимон просто обеспечивает среду, в которой это может произойти, но они не расходуются в процессе. Он состоит из двух электродов: один из цинка, другой из меди. Электролит представляет собой серную кислоту или смесь солевого раствора соли и воды. Электролит существует в форме 2H+ и SO42-. Цинк, который в электрохимическом ряду выше меди и водорода, реагирует с отрицательно заряженным сульфатом SO42- . Положительно заряженные ионы водорода (протоны) захватывают электроны меди, образуя пузырьки газообразного водорода h3. Это делает цинковый стержень отрицательным электродом, а медный стержень — положительным электродом.
Он состоит из двух электродов: один из цинка, другой из меди. Электролит представляет собой серную кислоту или смесь солевого раствора соли и воды. Электролит существует в форме 2H+ и SO42-. Цинк, который в электрохимическом ряду выше меди и водорода, реагирует с отрицательно заряженным сульфатом SO42- . Положительно заряженные ионы водорода (протоны) захватывают электроны меди, образуя пузырьки газообразного водорода h3. Это делает цинковый стержень отрицательным электродом, а медный стержень — положительным электродом. Положительная клемма представляет собой угольный стержень, окруженный смесью диоксида марганца и угольного порошка. В качестве электролита используется паста из хлорида цинка и хлорида аммония, растворенных в воде. Углеродный (графитовый) стержень собирает электроны, поступающие от анодной части батареи, чтобы вернуться к катодной части батареи. Углерод является единственным практичным материалом проводника, потому что любой обычный металл быстро подвергается коррозии в положительном электроде в электролите на основе соли.
Положительная клемма представляет собой угольный стержень, окруженный смесью диоксида марганца и угольного порошка. В качестве электролита используется паста из хлорида цинка и хлорида аммония, растворенных в воде. Углеродный (графитовый) стержень собирает электроны, поступающие от анодной части батареи, чтобы вернуться к катодной части батареи. Углерод является единственным практичным материалом проводника, потому что любой обычный металл быстро подвергается коррозии в положительном электроде в электролите на основе соли. Возможны и другие побочные реакции, но общую реакцию в угольно-цинковом элементе можно представить как:
Возможны и другие побочные реакции, но общую реакцию в угольно-цинковом элементе можно представить как: