Содержание
Триботехнический состав Suprotec Active Plus Бензин 90мл (присадка актив плюс супротек, 121144)
Купить Триботехнический состав Suprotec Active Plus Бензин 90мл (присадка актив плюс супротек, 121144)
Триботехнические составы серии «Active Plus» создают условия, при которых поверхности в узлах трения двигателя оказываются покрыты металлическим защитным слоем с особой структурой. Этот слой частично восстанавливает размеры и геометрию изношенных деталей, оптимизирует зазоры в парах трения, удерживает большее количество масла на поверхностях трения.
Это обеспечивает следующие эффекты от применения состава:
- Повышение мощности и экономия топлива — частичное восстановление износа ЦПГ и плотный масляный слой уплотняют зазоры в цилиндро-поршневой группе, обеспечивают необходимую газоплотность. Это восстанавливает компрессию и выравнивает ее по цилиндрам, повышает качество сгорания топлива. Кроме того, плотный масляный слой смещает режим трения в сторону гидродинамического, что снижает потери на трение.
 Все это приводит к увеличению мощности двигателя при одновременной экономии топлива на 6-8%.
Все это приводит к увеличению мощности двигателя при одновременной экономии топлива на 6-8%. - Снижение угара масла – защитный слой восстанавливает плотность узла гильза – кольцо – поршневая канавка. Это улучшает съем масла со стенок цилиндра и снижает его угар в камере сгорания, особенно при повышенных оборотах двигателя.
- Уменьшение вибрации и шумов – восстановление и выравнивание компрессии по цилиндрам приводит к ровной работе двигателя. Кроме того, плотный слой масла смягчает перекладку поршней. Все это снижает вибрацию и шум в двигателе.
- Снижение токсичности и дымности – восстановление компрессии и оптимизация зазоров в цилиндро-поршневой группе обеспечивают качественное сгорание топлива и снижают угар масла, что приводит к снижению токсичности и дымности двигателя.
- Восстановление функциональных свойств гидрокомпенсаторов – защитный слой восстанавливает оптимальные зазоры в гидрокомпенсаторах, что нормализует масляное давление и обеспечивает качественную работу механизма.
 Увеличение ресурса — защитный слой значительно снижает интенсивность изнашивания наиболее нагруженных деталей трения, которые определяют ресурс двигателя.
Увеличение ресурса — защитный слой значительно снижает интенсивность изнашивания наиболее нагруженных деталей трения, которые определяют ресурс двигателя. - Облегчение запуска и защита при «холодном пуске» – обработанные поверхности способны удерживать масляный слой при длительном простое. Это облегчает совершение первых оборотов и предотвращает повышенный износ двигателя при масляном голодании в момент запуска, что особенно актуально при отрицательной температуре окружающей среды.
- Защита при активной езде – обработанные поверхности удерживают более плотный масляный слой, который снижает износ и компенсирует масляное голодание в моменты быстрого набора оборотов двигател
Обработка двигателя триботехническим составом «Active Plus» производится в три этапа.
 На каждом этапе необходимо добавить состав в моторное масло согласно следующей процедуре.
На каждом этапе необходимо добавить состав в моторное масло согласно следующей процедуре.- Прогрейте двигатель до рабочей температуры (штатная эксплуатация).
- Заглушите двигатель.
- Тщательно перемешайте содержимое флакона, так чтобы осадок на дне распределился по всему объему жидкости.
- Залейте 1 флакон состава в маслозаливную горловину двигателя. (В случае, если объем масляной системы более 5 литров, необходимо залить два флакона состава).
- Сразу после добавления состава совершите поездку на автомобиле в течение 20-25 минут в режиме штатной эксплуатации.
После окончания процедуры автомобилем можно пользоваться в обычном режиме.
Полная обработка двигателя производится по следующей схеме:
Объем маслосистемы:
менее 5 литров
Более 5 литров
1 этап:
В рабочее масло добавляется:
1 флакон
2 флакона
Пробег не менее 1000 км
Замена масла и масляного фильтра *
2 этап:
В новое масло добавляется:
1 флакон
2 флакона
Пробег до штатной замены масла
Замена масла и масляного фильтра
3 этап:
В новое масло добавляется:
1 флакон
2 флакона
Пробег до штатной замены масла
Обычная эксплуатация
* Если пробег до штатной замены масла составляет более 1000 км, необходимо проводить капельную пробу масла каждые 500-1000 км.
 Если масло стало плотно чёрным, необходимо произвести его досрочную замену и перейти ко второму этапу.
Если масло стало плотно чёрным, необходимо произвести его досрочную замену и перейти ко второму этапу.я
Защита при повышенных нагрузках – защитный слой значительно эффективней предотвращает износ деталей трения при повышенных нагрузках за счет структурных особенностей (микротвердость и микроупругость) и удержания большего количества масла.
Отзывы «Триботехнический состав Suprotec Active Plus Бензин 90мл (присадка актив плюс супротек, 121144)»
Пока нет отзывов
Триботехнический состав СУПРОТЕК — Страница 3 — Двигатель, системы выпуска и охлаждения — Golf2club.com
#41
ДНК
Отправлено 25 March 2016 — 15:38 PM
http://suprotec.ru/s…-za-rulem-2012/
вот выжимка упоротости в одной статье. Механикам просьба прокомментировать. У понимающего в технике человека статья вызывает спонтанные приступы смеха. Супротек конечно победил. И в словах особых ошибок нет. Как и нет ничего полезного. Весь сюжет строится вокруг ощущений терпилы при каждой замене масла ( кстати испытываю эффект от замены масла регулярно-тоже чуть быстрее, выше, сильнее). Вроде какгбы чуть чуть, около того. Ни слова конкретного. Ибо за это можно юридически притягивать. А рекламные тексты выверены на этот момент однозначно. И ни слова о реальном хим. составе и действующих веществах.
Вроде какгбы чуть чуть, около того. Ни слова конкретного. Ибо за это можно юридически притягивать. А рекламные тексты выверены на этот момент однозначно. И ни слова о реальном хим. составе и действующих веществах.
http://nissan-libert…i-vpechatleniy/
какгбы опыт. Стоит ли он того? Если интересно, то подобную добавку супер ЕР видел в китайских супермаркетах в 2007-2009 годах. Потом они пропали с полок полностью и больше не появлялись. Китай кстати очень хорошо победил сетевой маркетинг и любые варианты финансовых пирамид. Устроителей просто расстреливают. Как думаете, почему во всем мире данное чудо не получило распостранения? ну хотя бы в кетае? если эффект есть? китайцы то любят экономить.
ключевая намазка — Кстати, если будет интерес, можно организовать клубный закуп составов по мелко-оптовым ценам. Могу задать вопрос производителям, если есть такой интерес. Обычно это -30% от розницы, иногда даже -40% (дилерские договоры), что даже с пересылкой будет дешевле. Но только надо человек 5 хотя бы желающих набрать чтобы был мелкий опт.
Ну возрази. Без суждений про истерики. Просто по каждому тезису.
Сообщение отредактировал ДНК: 25 March 2016 — 17:23 PM
- Наверх
#42
Chilak
Отправлено 27 March 2016 — 08:56 AM
Смешной ты
Как прочёл первые строчки, далее перестал читать
Сообщение отредактировал Chilak: 27 March 2016 — 08:57 AM
- Наверх
#43
ДНК
Отправлено 27 March 2016 — 19:57 PM
почитай тогда про силикат магния. Да вообще ничего не читай. На таких необразованных и держатся подобные бизнесы.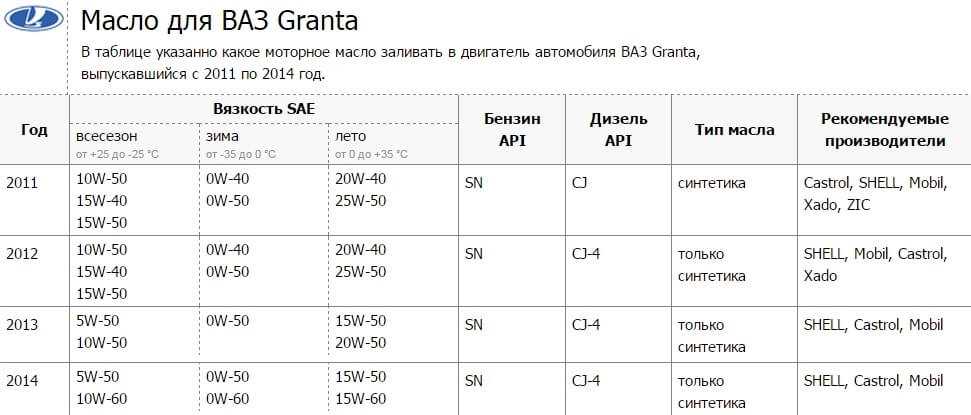 или на 40% накрутки намазался?
или на 40% накрутки намазался?
Сообщение отредактировал ДНК: 27 March 2016 — 19:57 PM
- Наверх
#44
Лука 161
Отправлено 28 March 2016 — 20:15 PM
И не лень столько буков писать?Пока вы здесь спорите,многие уже давно «засыпали» супратэка и радуются жизни втихаря….Честно,непонимаю скептиков.которые ни во что не верят,если не верить,то куда тогда скажите деньги тратить!!!
- Наверх
#45
ДНК
Отправлено 29 March 2016 — 03:12 AM
http://ru-tec.ru/?id=162
рутек нада покупать, он более вкусный и дешевый ! куда же еще деньги тратить. Не на себя любимого и не на семью. Только на наркоманские добавки. http://nissan-libert…i-vpechatleniy/ — вот смешное сборище упоротых наркоманов и терпил. И активных наемников-продавцов естественно. И все куда то заливают без остановки.А еще очистителя в бензин, раскоксовывателя в цилиндры, в вариатор с автоматами и мостами, да побольше. И так без остановки, каждую неделю сливать сотни денег, вот главная мысль всех барыжек этими соплями. Еще надо промывок в двигатель добавить от супротека, тогда вообще прИход сильный получается, заодно и сопли смоются, потом снова залить. Не понимаю скептиков — столько последователей кругом виртуальных, а они не ведутся и не хотят покупать гавно за 1.5к или за 6к набор, мелочь такая. Не дают продавцам заработать 50%. Когда идет речь о 300% прибыли, капиталист не остановится ни перед каким преступлением. А тут все 500% или 1000% у зеленькова и 50% у торгашей. Вот и стараются все, как могут. Продолжайте споры, это сильно доставляет.
Не на себя любимого и не на семью. Только на наркоманские добавки. http://nissan-libert…i-vpechatleniy/ — вот смешное сборище упоротых наркоманов и терпил. И активных наемников-продавцов естественно. И все куда то заливают без остановки.А еще очистителя в бензин, раскоксовывателя в цилиндры, в вариатор с автоматами и мостами, да побольше. И так без остановки, каждую неделю сливать сотни денег, вот главная мысль всех барыжек этими соплями. Еще надо промывок в двигатель добавить от супротека, тогда вообще прИход сильный получается, заодно и сопли смоются, потом снова залить. Не понимаю скептиков — столько последователей кругом виртуальных, а они не ведутся и не хотят покупать гавно за 1.5к или за 6к набор, мелочь такая. Не дают продавцам заработать 50%. Когда идет речь о 300% прибыли, капиталист не остановится ни перед каким преступлением. А тут все 500% или 1000% у зеленькова и 50% у торгашей. Вот и стараются все, как могут. Продолжайте споры, это сильно доставляет.
Сообщение отредактировал ДНК: 29 March 2016 — 03:26 AM
- Наверх
#46
jeager
Отправлено 15 April 2016 — 14:24 PM
мракобесие все это,на ряду со всякими экотопами и протэками на наноуровне. но лох не мамонт,он не вымрет
но лох не мамонт,он не вымрет
- Наверх
#47
ryros
Отправлено 25 April 2016 — 09:05 AM
с точки зрения химии все это херня, для диффузии а именно этим явлением является то что типа восстанавливает стенки нужно как минимум время — а его собсна нет ибо все масло постоянно вымываает данный состав , тогда нужно полимерная композиция которая состоит из инициатора , мономера, олигомера . Конкретно в нашем случае с супротеком инициатор проводит данную операцию получается под воздейтсвием температуры ибо больше таких факторов нет , но тогда возникает вполне резонный вопрос — 1- у каждого мотора разная рабочая температруа , т.е. по идее в каких то моторах это будет происходить в каких то нет , но идем дальше — масло у нас бадяжится с супротеком полностью , т. е. если все действовало бы так как нам заверяют былоб следующее по всей поверхности ( не только на цилиндрах, к сожалению избирательные функиции в моторе для вещест не сделать) а следовательно если б все это работало то каждый кто залил он бы через опр время ( короткое ) получит следующее — говно в дивгателе вместо масла , при том в прямом смысле слова похожее на смолу . Это один из исход которые каким либо образом обьяснимы , к сожалению мы пока не научились плавить метал при температуре окло 100гр(раб темп двигателя) .Если есть еще ккие то способы обьясните ) но вывод прост , в лучшем случае туда нахерачили чуть молибдена ( для эффекта того что что то действует) или вообще ничего
е. если все действовало бы так как нам заверяют былоб следующее по всей поверхности ( не только на цилиндрах, к сожалению избирательные функиции в моторе для вещест не сделать) а следовательно если б все это работало то каждый кто залил он бы через опр время ( короткое ) получит следующее — говно в дивгателе вместо масла , при том в прямом смысле слова похожее на смолу . Это один из исход которые каким либо образом обьяснимы , к сожалению мы пока не научились плавить метал при температуре окло 100гр(раб темп двигателя) .Если есть еще ккие то способы обьясните ) но вывод прост , в лучшем случае туда нахерачили чуть молибдена ( для эффекта того что что то действует) или вообще ничего
- Наверх
#48
Dugi
Отправлено 25 May 2016 — 11:35 AM
Давно не видел чтоб тут так бомбило у людец знатно :-):-) бамбалэриооооо 🙂
- Наверх
Автомобильные присадки для двигателя — для чего нужны и есть ли толк
Автомобильные присадки — вещество по типу смазки, которое добавляется в моторное масло для достижения различных целей.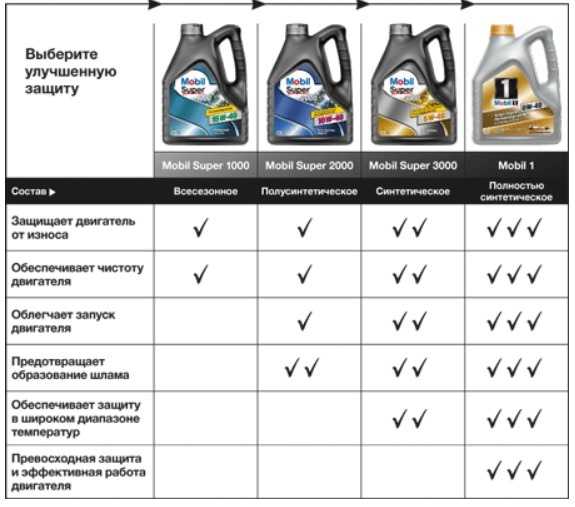 Они сулят повышенный ресурс мотора, экономию топлива и обещают вернуть изношенный двигатель к первоначальному состоянию. Есть ли толк от них?
Они сулят повышенный ресурс мотора, экономию топлива и обещают вернуть изношенный двигатель к первоначальному состоянию. Есть ли толк от них?
Антифрикционные присадки
Предназначены для реставрации внутренней поверхности двигателя с большим пробегом. Они призваны закрыть мелкие трещины в стенках цилиндра. Тем самым повысить компрессию и мощность двигателя. Производители обещают, что присадка поможет удалить грязь, нагар внутри двигателя и поддерживать его в чистом состоянии.
В процессе работы двигателя любое моторное масло неизбежно теряет свои свойства. Наиболее интенсивно это происходит в начальный период после смены масла, особенно при городском цикле езды.
Присадки компенсируют старение компонентов моторного масла. Они уменьшают потери на трение, снижают расход топлива и токсичность выхлопных газов.
Какой эффект
Не стоит верить рекламным материалам и верить в снижение расхода топлива в 20%. На самом деле, они дают экономию топлива в пределах 3-7% — тоже хороший результат. Наибольшая экономия будет при работе двигателя на холостом ходу и при малых нагрузках. В режиме номинальной мощности эффект практически исчезает. Поэтому в городском цикле езде можно опираться на эти цифры, а на трассе экономия составит не более 3%.
На самом деле, они дают экономию топлива в пределах 3-7% — тоже хороший результат. Наибольшая экономия будет при работе двигателя на холостом ходу и при малых нагрузках. В режиме номинальной мощности эффект практически исчезает. Поэтому в городском цикле езде можно опираться на эти цифры, а на трассе экономия составит не более 3%.
Присадки в двигатель способны увеличить мощность и, самое интересное, увеличить крутящий момент в зоне средних и низких оборотов. Это скажется на динамике, что может почувствовать любой автолюбитель. Это происходит за счет снижения трения и уменьшения механических потерь двигателя.
Присадки положительно влияют на компрессию мотора. Для двигателей с малым пробегом они могут выровнять значение компрессии во всех цилиндрах. Для двигателей с пробегом — восстановить компрессию дополнительно до 1,0-1,5 бар. Они сглаживают рабочие поверхности мотора, уменьшая высоту и размер микронеровностей.
Объяснение простое: в составе препаратов есть «строительный материал», который заделывает поврежденные поверхности. Перед применением данных присадок рекомендуется изначально проверить компрессию двигателя, а потом уже принимать решение.
Перед применением данных присадок рекомендуется изначально проверить компрессию двигателя, а потом уже принимать решение.
Для новых моторов нет смысла в применении присадок, лучшим средством для продления срока службы двигателя будет своевременная замена масла. Меняйте чаще масло и фильтры — тогда присадки не нужны. Для моторов с большим пробегом могут понадобиться средства для повышения надежности мотора и восстановления прежнего ресурса.
Топливосберегающие присадки
Служат для очищения топливной системы автомобиля из-за содержащихся в бензине грязи. Нужны, когда ощущается снижение мощности, т.е. машина начинает «тупить». Если часто заправляетесь на проверенных АЗС, то также может попасть грязь в топливную систему. Применять не стоит часто, одного раза в один-два года хватит.
Существуют присадки, которые добавляются в бензобак. Они удаляют воду и конденсат, которые постепенно накапливаются в бензобаке.
Антидымная присадка
Предназначена для стабилизации масла при высоких температурах, восстановления пакета присадок.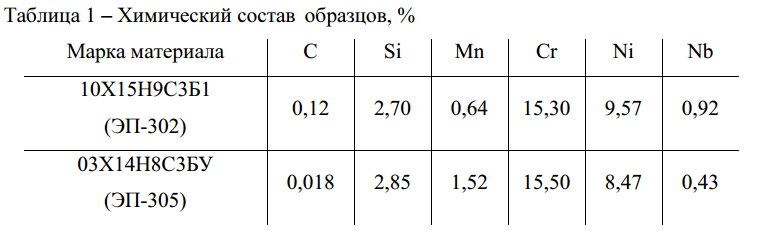 Подавляет образование нагара на стенках камеры сгорания, возникающего вследствие износа цилиндро-поршневой группы и маслосъемных колпачков. Стабилизируя вязкость масла при нагреве, предотвращает падения давления в системе смазки.
Подавляет образование нагара на стенках камеры сгорания, возникающего вследствие износа цилиндро-поршневой группы и маслосъемных колпачков. Стабилизируя вязкость масла при нагреве, предотвращает падения давления в системе смазки.
Данный вид снижает угар масла, дымность и шумность работы двигателя.
Если двигатель начал дымить и появился белый или синий дым, то никакая присадка не избавит от проблемы. Они только уменьшают количество дыма, например когда надо срочно продать авто.
Что выбрать
Как показывает личный опыт, автомобильные присадки в двигатель облегчают жизнь мотору. А какой состав применять зависит от первоначального состояния двигателя. Если автомобиль с малым пробегом, то подойдут присадки из группы геомодификаторов. Они улучшают характеристики мотора и увеличивают его ресурс. Их преимущество — можно залить один раз при замене масла и больше ничего не делать. Они дают долгосрочный эффект.
Если двигатель с большим пробегом, то следует выбирать сильнодействующие присадки, в составе которых имеется «микрокерамика» или другие металлизированные добавки. Они могут уменьшить расход масла на угар, снизить расход топлива, восстановить компрессию, тем самым восстановив надежность мотора. Следует помнить, что их придется применять при каждой замене масла.
Они могут уменьшить расход масла на угар, снизить расход топлива, восстановить компрессию, тем самым восстановив надежность мотора. Следует помнить, что их придется применять при каждой замене масла.
И общая задача данных присадок — лишь оттянуть срок неизбежного ремонта старого мотора, или всего лишь подготовить машину к быстрой продажи. Если не хотите экспериментировать на своей машине и не знаете что заливать — лучше не рисковать.
Виды присадок в моторные и трансмиссионные масла
Присадки – это вещества, которые добавляются в моторные масла, чтобы усилить эффективность базовых жидкостей и наделить их новыми свойствами. Такие добавки способны увеличить рабочий ресурс двигателя внутреннего сгорания с большим пробегом, повысить его мощность, уменьшить уровень шума во время работы, снизить расход горючего, поднять компрессию и в какой-то мере устранить течи из-под прокладок и сальников.
Присадки могут быть заводскими и индивидуальными. Первые добавляются в моторное масло производителями смазочных материалов, и их химический состав – закрытая информация. Индивидуальные присадки – это те, что можно купить в автомагазине или на рынке. Такие добавки используются водителями и сервисными центрами для решения каких-то конкретных задач с учетом фактического состояния двигателя. Какие виды присадок применяют сегодня заводы-изготовители и автовладельцы для улучшения рабочих характеристик моторных масел?
Индивидуальные присадки – это те, что можно купить в автомагазине или на рынке. Такие добавки используются водителями и сервисными центрами для решения каких-то конкретных задач с учетом фактического состояния двигателя. Какие виды присадок применяют сегодня заводы-изготовители и автовладельцы для улучшения рабочих характеристик моторных масел?
Вязкостные
В процессе использования моторного масла его эффективность постепенно снижается. Это особенно ощутимо, если машина часто простаивает в пробках, передвигается по бездорожью и эксплуатируется с перегрузками. Повысить вязкость смазочного материала при высоких температурах, не меняя свойств жидкости в холодное время, позволяют так называемые вязкостные присадки. Обычно это высокомолекулярные полимеры с переменной растворимостью в масле при разной температуре. Нередко эти вещества наделяют антиокислительными, дисперсными и другими свойствами, чтобы снизить общее число добавок в смазочной жидкости.
Противоизносные
Прямое предназначение этих присадок – снижение количества продуктов износа в моторном масле. Добавки такого типа усиливают смазывающую способность жидкости, образуя дополнительную защитную пленку в результате контакта с металлическими поверхностями. Вещества этого класса препятствуют образованию натиров, рисок, задиров, продлевая тем самым жизнь поршневым кольцам, цилиндрам, вкладышам подшипников и другим деталям двигателя. Высокую степень защиты от износа обеспечивают передовые пакеты присадок, которые используются в синтетических, полусинтетических и моторных маслах Rolf.
Добавки такого типа усиливают смазывающую способность жидкости, образуя дополнительную защитную пленку в результате контакта с металлическими поверхностями. Вещества этого класса препятствуют образованию натиров, рисок, задиров, продлевая тем самым жизнь поршневым кольцам, цилиндрам, вкладышам подшипников и другим деталям двигателя. Высокую степень защиты от износа обеспечивают передовые пакеты присадок, которые используются в синтетических, полусинтетических и моторных маслах Rolf.
Противопенные
Вспенивание моторного масла происходит чаще всего в результате смешивания смазочной жидкости с антифризом. Такое случается после разгерметизации системы охлаждения из-за пробоя прокладки головки блока цилиндров. Еще одна причина, по которой может вспениться масло, – несовместимость используемых видов смазочных материалов. Неполное растворение друг в друге двух взаимоисключающих видов продукта ведет к образованию конденсата, который и вызывает пенообразование. Вспененное масло сразу же теряет теплопроводность, вязкость, смазывающую способность. Уменьшить склонность масла к образованию пены помогают противопенные присадки.
Уменьшить склонность масла к образованию пены помогают противопенные присадки.
Антикоррозийные
Чтобы защитить внутренние поверхности двигателя от коррозии, эти присадки нейтрализуют кислоты, которые образуются в процессе интенсивной эксплуатации смазочной жидкости, а также при сгорании сернистого топлива. Для этой цели используются соединения, обладающие щелочными свойствами. Антикоррозийные добавки с содержанием серы, азота и фосфора образуют адсорбционную пленку, которая препятствует возникновению химических реакций кислот с металлами.
Антиокислительные
Для уменьшения скорости окисления масел и накопления в них продуктов этой химической реакции применяют антиокислительные присадки. Окислению смазочного материала способствует контакт с металлическими поверхностями и частицами износа, действующими как катализаторы. В результате изменяются химико-физические свойства масла, что ведет к ухудшению его эксплуатационных показателей. Если окислительный процесс зашел достаточно далеко, может потребоваться полная замена жидкости в системе смазки.
Дисперсные
Присадки этого типа сохраняют в виде суспензии твердые примеси, которые образуются в результате работы ДВС. Такие примеси могут представлять собой несгоревшие углеводороды, смолы, сажу, различные загрязнения и пр. Таким образом дисперсанты не допускают скопления твердых примесей и снижают степень закоксованности рабочих поверхностей двигателя.
Моющие
В состав этих добавок входят соли металлов на основе кальция или магния. Моющие присадки, или детергенты, препятствуют накоплению примесей и нагара в виде сажи, смолы, несгоревших углеводородов, грязи на деталях ДВС, испытывающих воздействие высоких температур, например, в канавках цилиндров. Их воздействие помогает бороться с углеродистыми осадками и окисленными смесями, а также с загрязнениями и смолистым налетом на металлических поверхностях.
Присадки в трансмиссионные масла и топливо
Не менее важную роль играют присадки трансмиссионных жидкостей. Они способны продлить срок службы коробки передач и повысить качество ее работы. При самостоятельном использовании этих добавок важно убедиться в их совместимости со смазочным материалом. Заводские присадки качественных масел для трансмиссии, например, из линейки продукции торговой марки Rolf, обладают высокими противоизносными, антикоррозийными и защитными свойствами, обеспечивая увеличенный рабочий ресурс оборудования. Определенную пользу могут принести также добавки в топливо. Предотвратить детонацию после заправки некачественным горючим можно с помощью октан- и цетан-корректоров (для бензиновых и дизельных моторов соответственно). Для профилактики загрязнений внутренних поверхностей двигателя многие водители применяют очищающие присадки.
При самостоятельном использовании этих добавок важно убедиться в их совместимости со смазочным материалом. Заводские присадки качественных масел для трансмиссии, например, из линейки продукции торговой марки Rolf, обладают высокими противоизносными, антикоррозийными и защитными свойствами, обеспечивая увеличенный рабочий ресурс оборудования. Определенную пользу могут принести также добавки в топливо. Предотвратить детонацию после заправки некачественным горючим можно с помощью октан- и цетан-корректоров (для бензиновых и дизельных моторов соответственно). Для профилактики загрязнений внутренних поверхностей двигателя многие водители применяют очищающие присадки.
Заключение
В составе большинства современных моторных и трансмиссионных масел уже имеются присадки, повышающие эффективность смазочных материалов. Если есть необходимость улучшить качество жидкости, применяют индивидуальные добавки. При этом, выбирая подходящий вид продукта, важно учитывать его совместимость с маслом, а также степень изношенности силового агрегата. В противном случае можно нанести вред узлам и механизмам автомобиля.
В противном случае можно нанести вред узлам и механизмам автомобиля.
Двухтопливный двигатель для тяжелых условий эксплуатации (HDDF) Тип 3B Определение
означает любое транспортное средство, разрешенная производителем полная масса которого превышает 6000 фунтов, за исключением легковых автомобилей.
означает электрическую цепь, включая соединительную систему для зарядки ПЭАС, работающую от высокого напряжения.
означает двигатель, который предназначен для одновременной работы на жидком топливе и газообразном топливе, причем оба топлива измеряются отдельно, при этом расход одного из видов топлива по отношению к другому может варьироваться в зависимости от режима работы;
означает абонентскую абонентскую абонентскую систему, которая представляет собой двадцать четыре (24) локальных контура передачи, объединенных в цифровой сигнал со скоростью 1,544 Мбит/с, который интегрируется в коммутаторе на уровне DS1.

означает продукт, предназначенный для очистки или удаления сложных загрязнений и загрязнений, таких как масло, жир, копоть, смола, шеллак, замазка, чернила для принтера, краска, графит, цемент, уголь, асфальт или клей, с рук с помощью или без использования воды. «Сверхмощное чистящее средство для рук или мыло» не включает лекарственные препараты, отпускаемые по рецепту, «Антимикробное чистящее средство для рук или тела или мыло», «Вяжущие средства/тонер», «Очищающее средство или мыло для лица», «Универсальное чистящее средство или мыло для рук или тела, «Лекарственное вяжущее средство/лечебный тоник» или «Протирочный спирт».
означает автомобиль с 2004 по 2006 модельного года, автомобиль большой грузоподъемности с низким уровнем выбросов, автомобиль со сверхнизким уровнем выбросов, автомобиль со сверхнизким уровнем выбросов или автомобиль с нулевым уровнем выбросов, сертифицированный в соответствии со стандартами раздела 13 CCR, раздел 1960.1. (h)(2) полная масса транспортного средства, указанная производителем, составляет 14 000 фунтов или менее; и любые модели 2004 года и последующие модели для тяжелых условий эксплуатации с низким уровнем выбросов, сверхнизким уровнем выбросов, супер-сверхнизким уровнем выбросов или нулевым уровнем выбросов, сертифицированные в соответствии со стандартами, указанными в заголовке 13, раздел 19 CCR.
 56.8(h) с разрешенной производителем полной массой транспортного средства от 8 501 до 14 000 фунтов.
56.8(h) с разрешенной производителем полной массой транспортного средства от 8 501 до 14 000 фунтов.означает устройство, которое преобразует электрическую энергию из потенциала, подаваемого рентгеновским контролем, в рабочий потенциал трубки. Устройство может также включать средства для преобразования переменного тока в постоянный, накальные трансформаторы для рентгеновской трубки (трубок), высоковольтные переключатели, электрические защитные устройства и другие соответствующие элементы.
означает пассажира, который прибывает в аэропорт на воздушном судне и вылетает из аэропорта на том же воздушном судне, если такое воздушное судно выполняет сквозной рейс с транзитом через аэропорт, и включает пассажира, следующего транзитом через аэропорт, который должен вылететь на замененном воздушном судне в связи с тем, что воздушное судно, на котором прибыл пассажир, признано неисправным.
означает дизельное топливо с содержанием серы не более 15 частей на меньшее количество человек) и подсубпозиции с 8703.
 21 по 8703.90, 8704.21 и 8704.31;
21 по 8703.90, 8704.21 и 8704.31;означает двигатель внутреннего сгорания с рабочими характеристиками, в значительной степени схожими с теоретическим циклом сгорания дизельного топлива. Регулирование мощности путем управления подачей топлива вместо дроссельной заслонки характерно для двигателя с воспламенением от сжатия.
означает систему DLC, которая имеет банк каналов терминала CO, подключенный к переключателям CO на аналоговой стороне.
означает производителя, который производит менее 1000 кг опасных отходов в течение календарного месяца.
означает комбинацию труб или шлангов, которые создают замкнутую систему между паровыми пространствами разгрузочной цистерны и приемной цистерны, так что пары, вытесняемые из приемной цистерны, передаются в разгружаемую цистерну.
или «C в расчетах CT» означает концентрацию дезинфицирующего средства, измеренную в миллиграммах на литр в репрезентативной пробе воды.

означает классификацию электрического компонента или цепи, если его рабочее напряжение составляет > 60 В и ≤ 1500 В постоянного тока или > 30 В и ≤ 1000 В переменного тока среднеквадратичное значение (среднеквадратичное значение).
означает немедленное снижение выработки или мощности или вывод из эксплуатации, полностью или частично, генерирующей установки по причине аварийной ситуации или угрозы аварийной ситуации, непредвиденного отказа или по другой причине, не зависящей от владельца или оператора объекта, как указано в соответствующих разделах руководств по PJM. Сокращение мощности или вывод из эксплуатации генерирующей установки в ответ на изменение рыночных условий не является вынужденным остановом генератора.
означает тип батареи, требующей жидкости и производящей газообразный водород, выбрасываемый в атмосферу.
означает сброс необработанных или
означает то же самое, что и этот термин, определенный в Разделе 41-22-2.

означает систему отвода как хозяйственно-бытовых, так и ливневых стоков.
означает плановый вывод из эксплуатации, полностью или частично, генерирующего блока для осмотра, технического обслуживания или ремонта с одобрения Управления по взаимодействию в соответствии с Руководствами PJM.
означает Ресурс генерирующей мощности, который работает не менее 90 процентов часов, которые он доступен для работы, как определено Управлением межсоединения в соответствии с Руководствами PJM.
означает любой материал, ставший радиоактивным с помощью ускорителя частиц.
означает чистящее средство, предназначенное для удаления жира, копоти, масла и других загрязнений с внешних поверхностей двигателей и других механических частей.
означает производителя, который не является участником рынка и чей генерирующий объект подключен к распределительной системе дистрибьютора, но не включает производителя, который потребляет больше электроэнергии, чем производит;
Испытания OCE и ISC PEMS
- Общие требования
- Требования к тестированию ISC
- Условия эксплуатации при испытаниях PEMS
- Оценка выбросов
Общие требования
Для европейских дорожных двигателей большегрузных грузовиков и автобусов испытания PEMS используются во время утверждения типа и испытаний на соответствие в процессе эксплуатации (ISC). При утверждении типа испытания PEMS транспортных средств, оснащенных сертифицируемым двигателем, являются частью испытаний на внецикловые выбросы (OCE); другим компонентом является испытание NTE на динамометрическом стенде двигателя. Тестирование PEMS серийного автомобиля после пробега не менее 25 000 км является основной мерой соответствия для тестирования ISC.
При утверждении типа испытания PEMS транспортных средств, оснащенных сертифицируемым двигателем, являются частью испытаний на внецикловые выбросы (OCE); другим компонентом является испытание NTE на динамометрическом стенде двигателя. Тестирование PEMS серийного автомобиля после пробега не менее 25 000 км является основной мерой соответствия для тестирования ISC.
Тестирование ISC требуется в течение 18 месяцев после первой регистрации автомобиля, зарегистрированного в ЕС, с пробегом не менее 25 000 км. Транспортные средства N3 должны быть испытаны, когда это применимо, с полуприцепом. В случае двухтопливных двигателей типа 1B, типа 2B и типа 3B требуется дополнительное испытание PEMS в дизельном режиме на том же двигателе и транспортном средстве сразу после или до проведения испытания PEMS в двухтопливном режиме.
Различия в испытаниях PEMS при утверждении типа и для ISC в основном заключаются в типе испытываемого транспортного средства, полезной нагрузке и накопленном пробеге, таблица 1. В таблице 1 также указаны температура и давление окружающей среды во время испытаний PEMS, а также требования к температуре охлаждающей жидкости. в начале тестирования PEMS. Даты ввода в эксплуатацию и другие требования, включая факторы соответствия, для испытаний OCE и ISC приведены в другом месте.
В таблице 1 также указаны температура и давление окружающей среды во время испытаний PEMS, а также требования к температуре охлаждающей жидкости. в начале тестирования PEMS. Даты ввода в эксплуатацию и другие требования, включая факторы соответствия, для испытаний OCE и ISC приведены в другом месте.
Для тяжелых дорожных двигателей как типовое одобрение, так и ISC требуют проведения испытаний PEMS для CO, HC, NMHC, CH 4 и выбросы PN.
| At Type Approval (OCE) | In-Service Conformity (ISC) | |
|---|---|---|
| Payload | 50-60% payload | 10-90% payload |
| Vehicle | Prototype или модифицированный серийный автомобиль разрешен | Серийный автомобиль |
| Мин. суммарное использование | Not specified | 25,000 km |
| Atmospheric pressure | P atm ≥ 82. 5 kPa 5 kPa | |
| Ambient Temperature | T atm ≥ -7°C and ≤ 0.4514·(101.3-P atm ) + 311 K | |
| Температура охлаждающей жидкости | ≤ T атм + 5°C и ≤ 30°C | |
Требования к тестированию ISC
Испытания на ISC должны повторяться не реже одного раза в 2 года для каждого семейства двигателей. По требованию изготовителя испытания могут быть прекращены через 5 лет после окончания производства.
Количество двигателей, подлежащих тестированию на ISC, может варьироваться от 3 до 10 в зависимости от совокупных результатов испытаний. Процедура выборки предназначена для количественного определения количества несоответствующих двигателей и принятия решений о прохождении/непрохождении испытаний в соответствии с таблицей 2. Процедура была разработана таким образом, чтобы вероятность того, что партия пройдет испытание с 20% дефектных транспортных средств или двигателей, составляет 0,90. (риск производителя = 10%), а вероятность того, что партия будет принята с 60% дефектных автомобилей или двигателей, равна 0,10 (риск потребителя = 10%). В то время как тестирования трех двигателей достаточно для принятия решения об отказе, этого недостаточно для принятия решения о прохождении. Дополнительные двигатели, до 10, должны быть испытаны, и количество несоответствующих двигателей должно быть не больше, чем указано номером решения о прохождении испытания для кумулятивного числа испытанных двигателей, прежде чем может быть принято решение о прохождении испытания.
(риск производителя = 10%), а вероятность того, что партия будет принята с 60% дефектных автомобилей или двигателей, равна 0,10 (риск потребителя = 10%). В то время как тестирования трех двигателей достаточно для принятия решения об отказе, этого недостаточно для принятия решения о прохождении. Дополнительные двигатели, до 10, должны быть испытаны, и количество несоответствующих двигателей должно быть не больше, чем указано номером решения о прохождении испытания для кумулятивного числа испытанных двигателей, прежде чем может быть принято решение о прохождении испытания.
| Cumulative number of engines tested (sample size) | Pass decision number | Fail decision number |
|---|---|---|
| 3 | — | 3 |
| 4 | 0 | 4 |
| 5 | 0 | 4 |
| 6 | 1 | 4 |
| 7 | 1 | 4 |
| 8 | 2 | 4 |
| 9 | 2 | 4 |
| 10 | 3 | 4 |
PEMS Условия эксплуатации
Тестирование PEMS проводится в городских условиях (0–50 км/ч), затем в условиях сельской местности (50–75 км/ч) и на автомагистралях (> 75 км/ч). Соотношение этих условий зависит от категории транспортного средства, табл. 3. Городской, сельский и автомобильный участки можно определить по географическим координатам (по карте) или по первому методу ускорения.
Соотношение этих условий зависит от категории транспортного средства, табл. 3. Городской, сельский и автомобильный участки можно определить по географическим координатам (по карте) или по первому методу ускорения.
В целях оценки состава поездки продолжительность каждой части рассчитывается с момента, когда температура охлаждающей жидкости впервые достигает 70°С или после того, как температура охлаждающей жидкости стабилизируется в пределах ±2°С в течение периода времени. 5 минут в зависимости от того, что наступит раньше, но не позднее, чем через 15 минут после запуска двигателя. Время, прошедшее до достижения температуры охлаждающей жидкости 70°С, следует эксплуатировать в городских условиях.
Следующее распределение характеристических значений отключения из базы данных WHDC (Всемирная гармонизированная сертификация тяжелого режима работы, Глобальные технические правила (GTR) № 4) может служить дополнительным руководством для оценки отключения:
- ускорение: 26,9% времени;
- замедление: 22,6% времени;
- крейсерская: 38,1% времени;
- остановка (скорость автомобиля = 0): 12,4% времени.

Продолжительность испытания должна быть достаточной для выполнения работы, в четыре-восемь раз превышающей объем работы, выполненной во время ВСПЦ, или для получения в четыре-восемь раз контрольной массы CO 2 в кг/цикл в зависимости от обстоятельств.
Если во время поездки в системе нейтрализации отработавших газов происходит непостоянная регенерация или во время испытаний возникают какие-либо неисправности бортовой системы диагностики, производитель может запросить аннулирование поездки.
| Городское вождение | Вождение в сельской местности | Вождение по автомагистрали | Вся поездка | ||
|---|---|---|---|---|---|
| Общие требования | Географические координаты | Скорость не должна превышать 50 км/ч в течение более чем 5% продолжительности городского участка | Скорость не должна превышать 75 км/ч (90 км/ч для M 1 и N 1 транспортных средств) для более чем 5% продолжительности сельского участка | ||
| Метод ускорения | Первое ускорение свыше 55 км/ч (70 км/ч в случае транспортных средств категорий M 1 и N 1 ) указывает на начало сельской части | Первое ускорение свыше 75 км/ч (90 км/ч для транспортных средств категорий M 1 и N 1 ) указывает на начало участка автомагистрали. | |||
| Требования к скорости | Средняя скорость от 15 до 30 км/ч | Средняя скорость от 45 до 70 км/ч (60 и 90 км/ч для автомобилей M 1 и N 1 ) | Средняя скорость выше 70 км/ч (90 км/ч для автомобилей M 1 и N 1 ) | ||
| Доля, классифицированная по продолжительности a , ±5% | M 1 и N 1 автомобили | 34% | 33% | 33% | |
| N 2 , M 2 и M 3 автомобили | 45% | 25% | 30% | ||
| M 2 и M 3 (класс I, II или A) транспортные средства | 70% | 30% | 0% | ||
| N 3 транспортные средства | 30% | 25% | 45% | ||
| Продолжительность | От 4 до 8 раз работа ВСПЦ или от 4 до 8 раз ВСПЦ СО 2 масса | ||||
a рассчитывается с момента, когда температура охлаждающей жидкости впервые достигает 70°C или после того, как температура охлаждающей жидкости стабилизируется в пределах ±2°C в течение 5 минут, в зависимости от того, что наступит раньше, но не позднее 15 минут после запуска двигателя. | |||||
Оценка выбросов
Методология
До двигателей Euro VI-D включительно выбросы при холодном пуске (т. е. при температуре охлаждающей жидкости < 70°C) исключены. Для двигателей Euro VI-E включена часть выбросов при холодном пуске, но исключены выбросы при температуре охлаждающей жидкости < 30°C. Оценка данных начинается, когда температура охлаждающей жидкости достигает 70°C для двигателей стандарта Euro VI-D и более ранних версий или 30°C для двигателей стандарта Euro VI-E в первый раз, или когда температура охлаждающей жидкости стабилизируется в пределах ±2°C в течение определенного периода времени. 5 минут, в зависимости от того, что наступит раньше, но в любом случае не позднее, чем через 10 минут после начала испытания.
Выбросы усредняются с использованием метода «окна усреднения», показанного в другом месте. Это процесс скользящего среднего, в котором продолжительность периода усреднения (окна) основана на механической работе или выбросах CO 2 , которые были измерены в ходе испытаний ВСПЦ во время испытаний для утверждения типа. Для метода, основанного на работе, эталонная работа (W ref ) равна работе [кВтч], произведенной двигателем на ВСПЦ, в то время как для метода, основанного на CO 2 , эталонная CO 2 (m CO2, ссылка ) соответствует массе [кг] CO 2 , измеренной над ВСПЦ. Длина окна при оценке данных равна времени, которое требуется для получения эталонной работы или эталонной массы CO 2 . Длина окна по времени может изменяться во время испытания в зависимости от средней выходной мощности двигателя. После того, как данные были проанализированы в окнах усреднения, идентифицируются действительные окна.
Для метода, основанного на работе, эталонная работа (W ref ) равна работе [кВтч], произведенной двигателем на ВСПЦ, в то время как для метода, основанного на CO 2 , эталонная CO 2 (m CO2, ссылка ) соответствует массе [кг] CO 2 , измеренной над ВСПЦ. Длина окна при оценке данных равна времени, которое требуется для получения эталонной работы или эталонной массы CO 2 . Длина окна по времени может изменяться во время испытания в зависимости от средней выходной мощности двигателя. После того, как данные были проанализированы в окнах усреднения, идентифицируются действительные окна.
Действительная рабочая Windows
До двигателей Euro VI-C включительно действительными рабочими окнами являются те, для которых средняя мощность превышает 20% от максимальной мощности двигателя (стр. 9).0129 макс ). Процент действительных окон должен быть равен или превышать 50%. Если процент допустимых окон меньше 50%, оценка данных повторяется с использованием более низких порогов мощности. Порог мощности уменьшается с шагом 1% до тех пор, пока процент действительных окон не станет равным или больше 50%, а средняя мощность не станет ниже 15% от P max . Тест считается недействительным, если процент действительных окон составляет менее 50% при 15% от P max .
Порог мощности уменьшается с шагом 1% до тех пор, пока процент действительных окон не станет равным или больше 50%, а средняя мощность не станет ниже 15% от P max . Тест считается недействительным, если процент действительных окон составляет менее 50% при 15% от P max .
Для двигателей Euro VI-D и более поздних допустимыми рабочими окнами являются те, для которых средняя мощность превышает 10% от P 9.0129 макс . Тест недействителен, если процент действительных окон составляет менее 50% или если после применения правила 90-го процентиля (см. ниже) не осталось действительных окон в городских операциях. Последнее предназначено для обеспечения того, чтобы влияние вождения в городских условиях на выбросы NOx отражалось в результатах испытаний.
Коэффициенты соответствия рассчитываются для каждого отдельного допустимого рабочего окна и каждого отдельного загрязняющего вещества:
CF = e / L(1)
где:
e = удельный выброс газообразного загрязняющего вещества для тормозов [мг/кВтч] или PN [#/кВтч];
L = применимый предел [мг/кВтч] или [#/кВтч].
Действительный CO
2 Окна
До двигателей Euro VI-C включительно действительными окнами на основе CO 2 являются окна, продолжительность которых не превышает максимальной продолжительности, рассчитанной из:
D макс. = 3600·Вт ref / (0,2·P макс. )(2)
где:
D max = максимальная длительность окна, с;
P max = максимальная мощность двигателя, кВт.
Если процент действительных окон меньше 50 %, оценка данных должна быть повторена с использованием более длительных окон. Это достигается уменьшением значения 0,2 в уравнении (2) с шагом 0,01 до тех пор, пока процент допустимых окон не станет равным или больше 50%. В любом случае пониженное значение в уравнении (2) не должно быть ниже 0,15. Тест считается недействительным, если процент действительных окон составляет менее 50% при максимальной продолжительности окна.
Для двигателей Euro VI-D и более поздних версий действительными окнами должны быть окна, продолжительность которых не превышает максимальной продолжительности, рассчитанной по уравнению (3). Тест считается недействительным, если процент действительных окон составляет менее 50%.
Тест считается недействительным, если процент действительных окон составляет менее 50%.
D макс. = 3600·Вт ref / (0,1·P макс. )(3)
Коэффициенты соответствия рассчитываются для каждого отдельного допустимого окна и каждого отдельного загрязняющего вещества.
CF = CF I / CF C (4)
CF I = m / (m CO2(t2,i) – m CO2(t1,i) )(5)
CF C = m L / m CO2, арт. (6)
где:
CF I = коэффициент обслуживания;
CF C = сертификационный коэффициент;
m = массовый выброс газообразного загрязняющего вещества [мг/окно], или PN [#/окно];
m CO2(t2,i) – m CO2(t1,i) = масса CO 2 во время i th окна усреднения [кг] и t 1,i и t 2, i — время начала и окончания окна i th соответственно;
м л = массовый выброс газообразного загрязнителя или PN, соответствующий применимому пределу ВСПЦ [мг] или [#] соответственно.
Окончательный коэффициент соответствия
Для двигателей Euro VI-E окончательный коэффициент соответствия (CF final ) для каждого загрязняющего вещества с использованием либо рабочего метода, либо метода на основе CO 2 составляет:
CF окончательная = 0,14 × CF холодная + 0,86 × CF теплая (7)
где:
CF холод — коэффициент соответствия периода холодной эксплуатации испытания, который должен быть равен наибольшему коэффициенту соответствия окон скользящего усреднения, начиная с температуры теплоносителя выше 30°С и ниже 70°С;
CF теплый — коэффициент соответствия периода теплой эксплуатации испытания, который должен быть равен 90 й кумулятивный процентиль коэффициентов соответствия.
Вплоть до двигателей Euro VI-D включительно окончательный коэффициент соответствия представляет собой 90 90 400 th 90 401 кумулятивный процентиль коэффициентов соответствия, рассчитанный либо по уравнению (1), либо по уравнению (4). Сюда не включены данные для работы двигателя при температуре ниже 70°C.
Сюда не включены данные для работы двигателя при температуре ниже 70°C.
Благодарности: Karsten Mathies из TÜV Hessen любезно предоставил ценные рекомендации и справочную информацию для этой статьи.
антарктическая психротрофная бактерия Halomonas sp. ANT-3b, растущий на н-гексадекане, продуцирует новый эмульгирующий гликолипид | FEMS Microbiology Ecology
Abstract
Бактериальный штамм ANT-3b был выделен на границе морской воды и льда на станции Terra Nova Bay, море Росса, Антарктида. Его выделяли на минеральной среде с добавлением 2% дизельного топлива в качестве единственного источника углерода и энергии и выращивали в обычном режиме на 2% н -гексадекана. Анализ последовательности гена 16S рРНК показывает, что штамм имеет 9Сходство последовательности 9,8% с Halomonas neptunia . Штамм ANT-3b выращивали на минеральной среде с добавлением н -гексадекана при температуре от 4 до 20 °С, но не при 30 °С. Максимальная скорость разложения n -алкана была измерена при 15 °C с 5,6 ± 1,7 мг O 2 мкг -1 белка d -1 . Штамм ANT-3b продуцировал эмульгирующие соединения при выращивании на н -гексадекане, но не на минеральной среде с добавлением d-фруктозы. Проведена предварительная характеристика эмульгатора. Липидная часть содержала смесь жирных кислот следующего состава в мольном соотношении: каприловая кислота 18,85, миристиновая кислота 1,0, пальмитиновая кислота 9.0,68, пальмитолеиновая кислота 5,69 и олеиновая кислота 1,26. Полисахаридная часть также содержала смесь сахаров со следующим молярным соотношением: манноза 1,71, галактоза 1,00 и глюкоза 2,96. Молекулярная масса гликолипидного компонента, определенная с помощью гель-проникающей хроматографии, находилась в диапазоне 18 кДа и содержала более мелкие фрагменты, возможно, олигомерные примеси. Трансмиссионная электронная микроскопия показала контакт между гликолипидом, секретируемым штаммом, и н -гексадеканом, расщепленным на нанокапли на границе раздела воды с образованием материала с мезофазной (жидкокристаллической) организацией.
Максимальная скорость разложения n -алкана была измерена при 15 °C с 5,6 ± 1,7 мг O 2 мкг -1 белка d -1 . Штамм ANT-3b продуцировал эмульгирующие соединения при выращивании на н -гексадекане, но не на минеральной среде с добавлением d-фруктозы. Проведена предварительная характеристика эмульгатора. Липидная часть содержала смесь жирных кислот следующего состава в мольном соотношении: каприловая кислота 18,85, миристиновая кислота 1,0, пальмитиновая кислота 9.0,68, пальмитолеиновая кислота 5,69 и олеиновая кислота 1,26. Полисахаридная часть также содержала смесь сахаров со следующим молярным соотношением: манноза 1,71, галактоза 1,00 и глюкоза 2,96. Молекулярная масса гликолипидного компонента, определенная с помощью гель-проникающей хроматографии, находилась в диапазоне 18 кДа и содержала более мелкие фрагменты, возможно, олигомерные примеси. Трансмиссионная электронная микроскопия показала контакт между гликолипидом, секретируемым штаммом, и н -гексадеканом, расщепленным на нанокапли на границе раздела воды с образованием материала с мезофазной (жидкокристаллической) организацией.
Адаптированный к холоду, n — Окисление гексадекана, Жирные кислоты, Эмульгатор, Проникание геля
1 Введение
Алифатические и ароматические углеводороды нефтяного происхождения являются серьезными загрязнителями окружающей среды из-за их стойкости и высокой токсичности для всех биологических систем. Загрязнение океанов нефтью стало проблемой с тех пор, как мы начали использовать ископаемое топливо. Биоразложение природными популяциями микроорганизмов является основным механизмом удаления нефти из окружающей среды. В частности, бактерии считаются лучшими агентами для разложения углеводородов, образующихся в результате разливов нефти. Скорость разложения нефти напрямую связана с доступностью углеводородов для микроорганизмов. Например, в 9Поглощение 0650 Pseudomonas aeruginosa , n -гексадекана является энергозависимым процессом [1]. Транспорт алканов в микробные клетки происходит путем прямого контакта с более крупными каплями алкана и путем псевдосолюбилизации вокруг клеточных оболочек. Этот процесс часто опосредуется несколькими эмульгирующими молекулами, которые облегчают поглощение углеводородов [1,2]. Производство различных типов эмульгирующих и/или поверхностно-активных молекул способствует образованию микромицелл углеводородов в воде [3].
Этот процесс часто опосредуется несколькими эмульгирующими молекулами, которые облегчают поглощение углеводородов [1,2]. Производство различных типов эмульгирующих и/или поверхностно-активных молекул способствует образованию микромицелл углеводородов в воде [3].
Большинство известных биосурфактантов и эмульгаторов представляют собой сложные молекулы, состоящие из нескольких липидных функциональных групп, связанных с гидрофильными углеводными остатками, сложность которых варьируется от простых дисахаридов до разветвленных олигосахаридов и полисахаридов. Многие другие молекулы потенциальных эмульгаторов могут быть идентифицированы на клеточном уровне; однако эти молекулы участвуют в определенных биологических функциях, и их использование в качестве антизагрязнителей вряд ли можно предвидеть. С другой стороны, эмульгаторы и биосурфактанты, продуцируемые бактериями, имеют конвергентные функции, что позволяет предположить, что они очень важны и что они развивались параллельно с генотипом и фенотипом [4].
Исследования микробных эмульгаторов в основном были сосредоточены на мезофильных бактериях [4,5]. В единичных публикациях сообщается об эмульгаторах и поверхностно-активных веществах, продуцируемых психрофильными и психротрофными бактериями [6–10]. Поскольку эти молекулы производятся при низких температурах, они представляют большой интерес для экологической биотехнологии, особенно для биоремедиации. Биодоступность углеводородов при низких температурах значительно снижается из-за затвердевания субстрата. Выделение адаптированных к холоду микроорганизмов, продуцирующих специфические молекулы, повышающие эмульгирование углеводородов, может иметь многообещающие применения.
В этой статье мы идентифицируем и описываем адаптированный к холоду бактериальный штамм, обозначенный как ANT-3b, который был выделен из антарктической морской воды и выращен в культуральной среде, обогащенной дизельным топливом в качестве единственного источника углерода, и обычно выращивался на n -гексадекане. . Цель состояла в том, чтобы определить некоторые молекулярные характеристики эмульгатора, образующегося при температуре 15 °C. Также сообщается о физиологических характеристиках, выделении и анализе состава этого сложного нового поверхностно-активного соединения.
. Цель состояла в том, чтобы определить некоторые молекулярные характеристики эмульгатора, образующегося при температуре 15 °C. Также сообщается о физиологических характеристиках, выделении и анализе состава этого сложного нового поверхностно-активного соединения.
2 Материалы и методы
2.1 Отбор проб
Пробы поверхностной морской воды были отобраны в Лагере В, площадка 3, море Росса, Антарктида (74°42′00″ ю.ш., 164°06′89″ в.д.), во время летней экспедиции 1999–2000 гг. В пакете было просверлено отверстие диаметром 40 см. Пробы воды отбирали в асептических условиях на границе вода–лед в бутылки Нискина, стерилизованные промыванием раствором 1 N HNO 3 . Образцы были обработаны сразу в лаборатории итальянской базы Terra Nova Bay в Антарктиде.
2.2 Условия культивирования и выделение
Морскую воду инкубировали при 4 °C в присутствии 2% по объему дизельного топлива до тех пор, пока в колбе не наблюдалась значительная плотность клеток. Дизельное топливо (Esso Italiana) для автомобилей с дизельными двигателями состоит из смеси алканов n (C 12 –C 28 ) со следами ароматических соединений (<30 ppm полициклических ароматических углеводородов (ПАУ)) и менее более 1% общих добавок; имеет плотность 0,830 г см -3 при 15 °С и вязкость 2,0–4,5 мм9.0400 2 с −1 при 40 °С. Дизельное топливо фильтровали через тефлоновый фильтр с размером пор 0,2 мкм (Sartoriuos) для стерилизации и удаления частиц. Бактериальные взвеси переносили на минеральную среду (ММ), содержащую: 24,0 г NaCl, 1,0 г MgSO 4 · 7H 2 O, 0,7 г KCl, 2,0 г KH 2 PO 4 , 3,0 г Na HPO 4 , 1,0 г NH 4 NO 3 на литр дистиллированной воды и снова инкубируют в тех же условиях в течение трех недель. Дизельное топливо было единственным источником углерода и энергии. Колонии, появляющиеся на чашках, очищали не менее чем трехкратным посевом на твердую минеральную среду с добавлением 50 мкл дизельного топлива.
Дизельное топливо (Esso Italiana) для автомобилей с дизельными двигателями состоит из смеси алканов n (C 12 –C 28 ) со следами ароматических соединений (<30 ppm полициклических ароматических углеводородов (ПАУ)) и менее более 1% общих добавок; имеет плотность 0,830 г см -3 при 15 °С и вязкость 2,0–4,5 мм9.0400 2 с −1 при 40 °С. Дизельное топливо фильтровали через тефлоновый фильтр с размером пор 0,2 мкм (Sartoriuos) для стерилизации и удаления частиц. Бактериальные взвеси переносили на минеральную среду (ММ), содержащую: 24,0 г NaCl, 1,0 г MgSO 4 · 7H 2 O, 0,7 г KCl, 2,0 г KH 2 PO 4 , 3,0 г Na HPO 4 , 1,0 г NH 4 NO 3 на литр дистиллированной воды и снова инкубируют в тех же условиях в течение трех недель. Дизельное топливо было единственным источником углерода и энергии. Колонии, появляющиеся на чашках, очищали не менее чем трехкратным посевом на твердую минеральную среду с добавлением 50 мкл дизельного топлива.
Рост суспендировали в 1,5 мл свежей минеральной среды и 30% стерильного глицерина и хранили в нескольких криопробирках при температуре -80 °C. Несколько других бактерий из разных колоний выращивали на минеральной среде с добавлением дизельного топлива, но только один штамм прижился на этой среде. Этот изолят представлял собой грамотрицательный аэробный микроорганизм, идентифицированный как штамм ANT-3b. Его выращивали в плановом порядке на 2% н -гексадекане, как единственном источнике углерода и энергии, заменяя дизельное топливо в минеральной среде.
2.3 Рост на
n -гексадекан
Штамм ANT-3b инокулировали 1:100 (3,2 ± 1,2 мкг белка мл -1 ) в 200 мл колбы, содержащие 50 мл минеральной среды с добавлением 2,0% n -гексадекана. Каждую колбу инкубировали в статическом режиме при 4, 15 или 30°С в разных инкубаторах. Рост контролировали, определяя содержание белка [11] как меру бактериальной биомассы.
2.4 Респирометрический тест
Тесты проводились с чистой жидкой культурой. Штамм ANT-3b инокулировали в 50 мл минеральной среды с добавлением n -гексадекан (2%) в качестве единственного источника углерода и энергии и инкубировали в течение 12 дней при 15°C при перемешивании. Потребление кислорода штаммом ANT-3b использовали для косвенного определения разложения н -гексадекана. Его измеряли с помощью автоматизированной системы управления OxiTop ® (WTW, Wissenschaftlich-Technische-Werkstaetten, Weilheim, Germany) в герметичных сосудах для образцов с датчиками давления, поддерживаемыми при постоянной температуре. Поскольку биологические процессы потребляют кислород и образуют углекислый газ, этот газ улавливается щелочным абсорбентом (гидроксидом натрия) в стеклянном боковом отводе. С интервалами в 20 минут, как это было предложено в протоколе, регистрировали снижение давления в головном пространстве биореактора с помощью дистанционного зондирования. Давление было преобразовано в биологическую потребность в кислороде (БПК) с использованием уравнения OxyTop 9.Протокол 0400 ® . В разное время отбирали аликвоты объемом 3,0 мл для определения содержания белка [11]. Единственный биореактор допускал замену кислорода в свободном пространстве, поэтому рост ограничивался неорганическими питательными веществами и источником углерода. Потребление кислорода рассчитывали по отношению к содержанию белка.
Давление было преобразовано в биологическую потребность в кислороде (БПК) с использованием уравнения OxyTop 9.Протокол 0400 ® . В разное время отбирали аликвоты объемом 3,0 мл для определения содержания белка [11]. Единственный биореактор допускал замену кислорода в свободном пространстве, поэтому рост ограничивался неорганическими питательными веществами и источником углерода. Потребление кислорода рассчитывали по отношению к содержанию белка.
2.5 Определение и анализ последовательности гена 16S рРНК
Единственную колонию штамма ANT-3b, выделенную на чашке с агаром, собирали и растворяли в 50 мкл дважды профильтрованной дистиллированной H 2 O и выдерживали при 100 °C в течение 5 мин. Амплификацию гена 16S рРНК и секвенирование нуклеотидов проводили Bact16S service Bio Molecular Research (Центр биотехнологии CRIBI, Университет Падуи, Италия). Полную последовательность гена 16S рРНК определяли путем амплификации на термоциклере ABI 9600 (Perkin-Elmer Applied Biosystems). Продукт амплификации очищали с помощью колонок для очистки ПЦР QIAquick (Qiagen) в соответствии с протоколом производителя. Прямое определение последовательности очищенной ДНК проводили с использованием набора для секвенирования Prism Ready Reaction DyeDeoxy Terminator по протоколам производителя (Perkin-Elmer Applied Biosystems) и автоматического ДНК-секвенатора модели 3100 (Applied Biosystems). Анализ полученных последовательностей проводили с использованием программ Similarity_matrix версии 1.1, sequence_match версии 2.7 и sequence_align версии 1.7 из проекта рибосомной базы данных (RDP) и blast[12], как описано в [10]. Программа NEIGHBOR использовалась для построения филогенетических деревьев из матриц эволюционных расстояний методом Neighbor-joining [13]. Случайный порядок ввода последовательностей и множественное укоренение внешних групп с последовательностями гена 16S рРНК из Escherichia coli и Cellulomonas fermentans использовали, чтобы избежать потенциальной систематической ошибки, вызванной порядком добавления последовательности.
Продукт амплификации очищали с помощью колонок для очистки ПЦР QIAquick (Qiagen) в соответствии с протоколом производителя. Прямое определение последовательности очищенной ДНК проводили с использованием набора для секвенирования Prism Ready Reaction DyeDeoxy Terminator по протоколам производителя (Perkin-Elmer Applied Biosystems) и автоматического ДНК-секвенатора модели 3100 (Applied Biosystems). Анализ полученных последовательностей проводили с использованием программ Similarity_matrix версии 1.1, sequence_match версии 2.7 и sequence_align версии 1.7 из проекта рибосомной базы данных (RDP) и blast[12], как описано в [10]. Программа NEIGHBOR использовалась для построения филогенетических деревьев из матриц эволюционных расстояний методом Neighbor-joining [13]. Случайный порядок ввода последовательностей и множественное укоренение внешних групп с последовательностями гена 16S рРНК из Escherichia coli и Cellulomonas fermentans использовали, чтобы избежать потенциальной систематической ошибки, вызванной порядком добавления последовательности. Полученные деревья были проанализированы с помощью программы CONSENSE, чтобы обеспечить оценки достоверности для топологий филогенетических деревьев и построить дерево консенсуса по правилу большинства.
Полученные деревья были проанализированы с помощью программы CONSENSE, чтобы обеспечить оценки достоверности для топологий филогенетических деревьев и построить дерево консенсуса по правилу большинства.
Последовательность гена 16S рРНК, определенная в этом исследовании, была внесена в базу данных нуклеотидных последовательностей EMBL под номером доступа AY616755.
2.6 Экстракция гликолипидов
Экстракцию гликолипидов проводили из фракции Н-2 по методике, описанной ниже. После центрифугирования микробного бульона (6000 об/мин, 20 мин, 20°С) надосадочную жидкость отделяли от водной (основной) фракции. Водную фракцию фильтровали, подвергали диализу и сушили вымораживанием (фракция Н-1). Супернатант экстрагировали метилбутиловым эфиром (MtBE) и затем центрифугировали. Поверхность раздела масло/вода собирали, многократно центрифугировали и промывали дистиллированной водой, а затем сушили (фракция Н-2). Предварительный анализ содержания белка проводили по методу Брэдфорда [11]. Фракция Н-2 анализировалась электрофорезом в SDS по стандартной методике.
Фракция Н-2 анализировалась электрофорезом в SDS по стандартной методике.
2.7 Сахарный состав гликолипида
Состав углеводного компонента во фракции Н-2 определяли гидролизом в трифторуксусной кислоте 2 N (100 °С, 6 ч). Нейтральные моносахариды, высвобождаемые при гидролизе, дериватизировали по методике Блейкени [14], а образовавшиеся ацетаты альдитов анализировали методом газожидкостной хроматографии (ГЖХ) [7] на хроматографе GLC Perkin-Elmer Autosystem XL с использованием He в качестве газа-носителя. Использовали капиллярную колонку SP2330, 30 м × внутренний диаметр 0,25 мм, пленку 0,20 мкм (Supelco). Температура колонки изначально была установлена на уровне 200°C в течение 1 мин и запрограммирована на линейное повышение при 4°C мин -1 до 245 °С; при этой температуре тепловая программа была изотермически остановлена. Температура инжектора и блока детекторов составляла 280 °С. Количественное определение аналитов проводили методом внутреннего стандарта с инозитолом.
2.8 Жирнокислотный состав
Жирнокислотный состав липидной части анализировали методом, описанным в литературе [15]. Образец Н-2 (10 мг) обрабатывали 1,2 мл 0,5 М метанольного раствора NaOH при 70°С в течение 1 ч; затем 1,5 мл 15% метанольного БФ 9Добавляли 0129 3 и смесь инкубировали при 70 °C в течение 15 мин. Метиловые эфиры экстрагировали 1,2 мл гексана. Разделению фаз способствовало добавление 1 мл насыщенного водного раствора NaCl. Экстракт гексана переносили во флакон, сушили в сухом потоке N 2 , растворяли в 0,25 мл гептана и анализировали с помощью ГЖХ. Прибор и условия работы были такими же, как указано выше, за исключением тепловой программы (начальная температура 140 °С, начальная выдержка 5 мин, линейное изменение температуры 4 °С мин. -1 до 240 °С, выдержка 10 мин) и температуру блока форсунок (250 °С).
2.
 9 Гель-проникающая хроматография (ГПХ)
9 Гель-проникающая хроматография (ГПХ)
Две стеклянные колонки (1500 × 18 мм) были заполнены хроматографическими материалами Biorad: одна колонка с Biogel P2, (диапазон фракционирования 100–1800 Da), а другая колонка с Biogel P-10 (диапазон фракций 1500–20 000 Да). Скорость потока 1,0 мл ч -1 доставляли с использованием перистальтического насоса Pharmacia-LKB. Выходящий из колонки поток контролировали на наличие пиков компонентов с использованием дифференциального рефрактометра Waters R-401. Во всех экспериментах ГПХ элюент содержал NaCl 0,05 М, NaN 3 0,05% и SDS 0,05%.
Эталонные материалы для калибровки системы ГПХ представляли собой олигомеры сахаров и олигомеры декстрана (Fluka) с подходящим диапазоном распределения молекулярных масс. В качестве маркера общего объема использовали глюкозу ( V t ) и декстран MR 500 кДа в качестве маркера исключенного объема ( V o ). Несколько образцов фракции Н-2 готовили растворением в элюенте ГПХ в концентрации 6 мг/мл -1 .
2.10 Локализация нейтральных липидов с помощью эпифлуоресцентного микроскопа
n -Гексадекан-индукцию гликолипидов качественно наблюдали в штамме ANT-3b с использованием уже испытанного протокола Nile Red [16] для определения липополисахаридного эмульсана в Acinetobacter sp. РАГ-1. Штамм выращивали в экспоненциальной фазе на двух разных минеральных средах, содержащих 1% фруктозы или 2% н -гексадекана в качестве источника углерода и энергии. Клетки ANT-3b выращивали пять раз подряд на минеральной среде с фруктозой (1%) для подавления их способности к росту сразу на н -гексадекан. В то же время другие клетки непрерывно переносили на минеральную среду с добавлением н -гексадекан в качестве единственного источника углерода. Аликвоту 1 мл каждой культуры в экспоненциальной фазе центрифугировали при 12000 g в течение 5 мин. Осадки клеток суспендировали в фосфатно-солевом буфере (PBS) и инкубировали в течение 30 мин. с 10 мкл нильского красного (оксазон нильского синего А) (Sigma), флуорохрома, специфичного для нейтральных липидов [16]. Их центрифугировали и дважды промывали 1 мл PBS при pH 6,9., содержащий 1,55 г K 2 HPO 4 и 0,85 г NaH 2 PO 4 · H 2 O на литр. Наконец, клетки снова суспендировали в PBS и 20 мкл Nile Red (0,01 мг/мл -1 ) и затем исследовали на предметных стеклах с помощью эпифлуоресцентной микроскопии (Olympus мод. BX 51), оснащенной цифровой камерой. Процедуру контроля выполняли путем добавления флуоресцеинизотиоцианата (FITC) (Sigma), обычного флуорохрома, для окрашивания всех клеток. Оригинальные фотографии образцов были экспортированы в формате Tiff в Power Macintosh G3. Относительную интенсивность флуоресценции измеряли с помощью программного обеспечения NIH image 1.62b.
с 10 мкл нильского красного (оксазон нильского синего А) (Sigma), флуорохрома, специфичного для нейтральных липидов [16]. Их центрифугировали и дважды промывали 1 мл PBS при pH 6,9., содержащий 1,55 г K 2 HPO 4 и 0,85 г NaH 2 PO 4 · H 2 O на литр. Наконец, клетки снова суспендировали в PBS и 20 мкл Nile Red (0,01 мг/мл -1 ) и затем исследовали на предметных стеклах с помощью эпифлуоресцентной микроскопии (Olympus мод. BX 51), оснащенной цифровой камерой. Процедуру контроля выполняли путем добавления флуоресцеинизотиоцианата (FITC) (Sigma), обычного флуорохрома, для окрашивания всех клеток. Оригинальные фотографии образцов были экспортированы в формате Tiff в Power Macintosh G3. Относительную интенсивность флуоресценции измеряли с помощью программного обеспечения NIH image 1.62b.
2.11 Просвечивающая электронная микроскопия
Клетки, выращенные на минеральной среде с фруктозой или н -гексадеканом, были подготовлены для просвечивающей электронной микроскопии (ПЭМ). После семи дней инкубации при 15 °C клетки ANT-3b собирали центрифугированием при 11 000 g . Бактериальный осадок фиксировали в течение 1 ч при 4°С 2,5% глутаральдегидом и 0,1 М лизина в 0,066 М какодилатном буфере, рН 7,2, в течение 30 мин при комнатной температуре. Клетки промывали пять раз в том же буфере и затем фиксировали в течение 1 ч при комнатной температуре в 1% четырехокиси осмия, затем промывали дистиллированной водой и заключали в смолу Spurr. Ультратонкие срезы готовили на ультрамикротоме LKB II Nova с алмазным ножом. Срезы окрашивали 3,0% раствором уранилацетата в течение 15 мин, однократно промывали дистиллированной водой и инкубировали в цитрате свинца в течение 10 мин. Наблюдения в ПЭМ проводились на JEOL JEM 100b (Токио, Япония), работающем в стандартных условиях.
После семи дней инкубации при 15 °C клетки ANT-3b собирали центрифугированием при 11 000 g . Бактериальный осадок фиксировали в течение 1 ч при 4°С 2,5% глутаральдегидом и 0,1 М лизина в 0,066 М какодилатном буфере, рН 7,2, в течение 30 мин при комнатной температуре. Клетки промывали пять раз в том же буфере и затем фиксировали в течение 1 ч при комнатной температуре в 1% четырехокиси осмия, затем промывали дистиллированной водой и заключали в смолу Spurr. Ультратонкие срезы готовили на ультрамикротоме LKB II Nova с алмазным ножом. Срезы окрашивали 3,0% раствором уранилацетата в течение 15 мин, однократно промывали дистиллированной водой и инкубировали в цитрате свинца в течение 10 мин. Наблюдения в ПЭМ проводились на JEOL JEM 100b (Токио, Япония), работающем в стандартных условиях.
3 Результаты
Бактериальный штамм ANT-3b был выделен из морской воды, отобранной на расстоянии 700 м от итальянской базы в Антарктиде в культурах обогащения с дизельным топливом при 4 °C после 10 дней инкубации. Штамм представлял собой грамотрицательный гетеротрофный организм, образующий круглые колонии на твердой среде. Его культивировали обычным образом в жидкой минеральной среде с 2% н -гексадекана в качестве единственного источника углерода и энергии.
Штамм представлял собой грамотрицательный гетеротрофный организм, образующий круглые колонии на твердой среде. Его культивировали обычным образом в жидкой минеральной среде с 2% н -гексадекана в качестве единственного источника углерода и энергии.
Штамм ANT-3b был выделен при 4 °C и начал расти на н -гексадекан при этой температуре только через 10 сут, достигая максимума 15 мкг белка мл -1 через 17 сут, как косвенный показатель биомассы (рис. 1). Видимое образование внеклеточных продуктов во время роста вызывало проблемы при подсчете клеток под микроскопом, даже при использовании метода чашечного посева, в котором единицы, образующие колонии, недооценивались из-за естественной агрегации клеток. Таким образом, за производством биомассы косвенно следили путем определения образования белка в культуре. Штамм ANT-3b процветал при 15 °C в присутствии n — гексадекан как единственный источник углерода и энергии. Он начал расти через один день и достиг максимальной биомассы (50 мкг белка/мл -1 ) через семь дней. Рост ANT-3b не был обнаружен через 15 дней при температуре инкубации 30°С. Однако рост наблюдался до 21 °С.
Рост ANT-3b не был обнаружен через 15 дней при температуре инкубации 30°С. Однако рост наблюдался до 21 °С.
1
Открыть в новой вкладкеСкачать слайд
Рост Halomonas sp. ANT-3b определяется как продукция белка (мкг мл -1 ) при 4 °C (▪), при 15 °C (●) и при 30 °C (▲) в минеральной среде с добавлением 2% н -гексадекан.
Непрямой тест для определения окисления n -гексадекана проводили путем определения дыхания кислородом с использованием протокола Oxytop TM при 15 °C. Биологическая потребность в кислороде (БПК) штамма ANT-3b начала увеличиваться через двое суток инкубации, через сутки после начала роста и достигла максимума 1000 мг О 2 л -1 через 11 суток. Окисление углеводородов рассчитывали по отношению к образованию биомассы со скоростью 5,6 ± 1,7 (мг O 2 ) (мкг белка) -1 d -1 . Измерения контролей БПК в тех же условиях с мертвыми клетками и в присутствии живых клеток, но без н -гексадекана, составили <0,5 мг О 2 1 -1 .
Вид штамма ANT-3b был окончательно определен путем секвенирования гена, кодирующего 16S рРНК. Филогенетический анализ был проведен на выровненных последовательностях гена 16S рРНК с использованием методов максимального упрощения (MP) и максимального правдоподобия (ML). Определена почти полная последовательность гена, кодирующего 16S рРНК, в изоляте ANT-3b (1471 п.н.). Предварительные базы данных RDP [12,17] указывали на принадлежность организма к гамма Протеобактерии . Последовательность вручную выровнена по представителям гаммапротеобактерий с использованием модели вторичной структуры бактериальной 16S рРНК [18]. На основании сходства 16S рРНК ANT-3b показал очевидное родство с бактериями, принадлежащими к сборке Halomonas , и образовал стабильную филетическую группу в гетерогенном кластере H. variabilis-neptunia-glaciei , состоящем в основном из изолированных штаммов. в холодных условиях (рис. 2). Ближайшими родственниками штамма ANT-3b являются H. neptunia DSM15720 T (99,8%) Идентичность последовательности гена 16S рРНК [19], H. glaciei JCM11692 T (99,1%) и H. variabilis DSM и несколько других еще недостаточно описанных галомонад, выделенных из полярных морей (99,4–99,6%).
neptunia DSM15720 T (99,8%) Идентичность последовательности гена 16S рРНК [19], H. glaciei JCM11692 T (99,1%) и H. variabilis DSM и несколько других еще недостаточно описанных галомонад, выделенных из полярных морей (99,4–99,6%).
2
Открыть в новой вкладкеСкачать слайд
Предполагаемое филогенетическое положение Halomonas sp. ANT-3b среди близкородственных представителей семейства Halomonadaceae, полученный в результате сравнения последовательностей генов 16S рРНК. E. coli и C. fermentans использовали для многократного аутгруппирования и укоренения соответственно. Бактерии, выделенные из холодных сред, выделены жирным шрифтом. Числа в узлах, связанные с позиционированием используемых последовательностей, указывают процентную долю встречаемости в 100 загруженных деревьях (показаны только значения >60). Белые кружки показывают принадлежность, полученную путем сравнения полных последовательностей; черные кружки обозначают положения, подтвержденные сравнением полных и частичных (33) последовательностей. Полоса указывает генетическое расстояние 0,05.
Полоса указывает генетическое расстояние 0,05.
Во время роста Halomonas sp. ANT-3b на n -гексадекане при 15 °C образовалась плавающая эмульсия на границе воздух-среда. Эмульгатор собирали и очищали (фракция Н-2) для химического и физико-химического анализа гликолипида. Состав углеводов во фракции Н-2 определяли методом ГЖХ производных ацетата альдита. Пики моносахаридов идентифицировали путем калибровки со стандартными моносахаридами. Все пики в гексозном диапазоне были четко идентифицированы. Два пика между пентозным и гексозным диапазонами на этой стадии оставались неидентифицированными. Количественное определение аналитов проводили методом внутреннего стандарта с инозитом в качестве внутреннего стандарта, что дало следующий состав в молярном соотношении: Man = 1,71, Gal = 1,00, Glu = 2,9.6. Ни рамнозы, ни аминосахаров не было, и другие распространенные сахара не могли быть отнесены к неизвестным пикам.
Жирнокислотный состав липидного фрагмента анализировали с помощью ГХ после дериватизации в метиловые эфиры. Пики жирных кислот идентифицировали путем сравнения времени удерживания со стандартами. Пять из восьми пиков были однозначно идентифицированы. Аналиты были количественно определены методом внутреннего стандарта с нонадеканоатом натрия, что дало следующий состав в молярном соотношении: каприловая кислота: 18,85, миристиновая кислота: 1,00, пальмитиновая кислота: 9.0,68, пальмитолеиновая кислота: 5,69, олеиновая кислота: 1,26. Таким образом, приблизительное соотношение C 8:0 , C 16:0 , C 16:1 составляло 3, 1,5, 1 для основных компонентов с небольшими количествами других ацильных цепей.
Пики жирных кислот идентифицировали путем сравнения времени удерживания со стандартами. Пять из восьми пиков были однозначно идентифицированы. Аналиты были количественно определены методом внутреннего стандарта с нонадеканоатом натрия, что дало следующий состав в молярном соотношении: каприловая кислота: 18,85, миристиновая кислота: 1,00, пальмитиновая кислота: 9.0,68, пальмитолеиновая кислота: 5,69, олеиновая кислота: 1,26. Таким образом, приблизительное соотношение C 8:0 , C 16:0 , C 16:1 составляло 3, 1,5, 1 для основных компонентов с небольшими количествами других ацильных цепей.
Были предприняты и другие попытки охарактеризовать фракцию Н-2, плохая растворимость которой в воде не создавала проблем при химическом анализе, где использовались методы разложения. Хотя было обнаружено, что растворитель ДМСО растворяет образец, предпочтение отдавалось водному раствору, содержащему 0,05% SDS в качестве сорастворимого вещества для хроматографического (ГПХ) определения молекулярной массы. Этот растворитель был гораздо более податлив, чем ДМСО, в колонке и детекторе показателя преломления, поскольку ДМСО гигроскопичен. Было определено, что нижний предел молекулярной массы гликолипидного компонента фракции Н-2 составляет около 18 кДа (рис. 3), с другими более мелкими фрагментами (в незначительных количествах), которые могут возникать в результате деградации или олигомерных загрязнителей. Анализ содержания белка во фракции Н-2 проверяли электрофорезом в той же системе в SDS и подтверждали отсутствие полос белка. Молекулярная масса должна быть подтверждена более строгими методами (например, масс-спектрометрией или светорассеянием), однако полученное значение указывает на то, что гликолипид с эмульгирующей активностью имеет молекулярную массу в диапазоне аналогичных биополимеров, обнаруженных в некоторых грамотрицательных микроорганизмах. [20].
Этот растворитель был гораздо более податлив, чем ДМСО, в колонке и детекторе показателя преломления, поскольку ДМСО гигроскопичен. Было определено, что нижний предел молекулярной массы гликолипидного компонента фракции Н-2 составляет около 18 кДа (рис. 3), с другими более мелкими фрагментами (в незначительных количествах), которые могут возникать в результате деградации или олигомерных загрязнителей. Анализ содержания белка во фракции Н-2 проверяли электрофорезом в той же системе в SDS и подтверждали отсутствие полос белка. Молекулярная масса должна быть подтверждена более строгими методами (например, масс-спектрометрией или светорассеянием), однако полученное значение указывает на то, что гликолипид с эмульгирующей активностью имеет молекулярную массу в диапазоне аналогичных биополимеров, обнаруженных в некоторых грамотрицательных микроорганизмах. [20].
3
Открыть в новой вкладкеСкачать слайд
Гель-проникающая хроматография фракции H-2 на колонке Biogel P-10 (диапазон фракционирования: 1500–20 000 Да). Основной пик приходится на 18 кДа.
Основной пик приходится на 18 кДа.
Для определения внеклеточной продукции этого эмульгатора Halomonas sp. ANT-3b возникает только в присутствии н -гексадекана или всегда, клетки также культивировали в минеральной среде с d-фруктозой. Распределение нейтральных липидов на клетках проводили с использованием Nile Red, специфического флуоресцентного красителя для нейтральных липидов. Флуоресценция этого хромофора была очевидна только в клетках, индуцированных к окислению 9.0650 n -гексадекан (рис. 4(а)), тогда как неиндуцированные клетки, пять раз перенесенные в минеральную среду с d-фруктозой, показали снижение флуоресценции на 75%, как было измерено с помощью анализа изображений (рис. 4(б)) . Контроль этого теста на окрашивание проводили с использованием изотиоцианата флуоресцеина (рис. 4(c) и (d)), образцы культивировали в н -гексадекане и фруктозе.
4
Открыть в новой вкладкеСкачать слайд
Микроскопическое определение (×1000) образования гликолипидов в Halomonas sp. Клетки ANT-3b с помощью Nile Red, хромофора для нейтральных липидов, и его контроль с помощью неспецифического красителя, такого как изотиоцианат флуоресцеина. (а) Клетки, растущие на минеральной среде с добавлением н -гексадекана (2% масс.:об.) и окрашенные Нильским красным. ( б ) Клетки, растущие на минеральной среде с добавлением d-фруктозы (2% вес: объем) и окрашенные Нильским красным. Обратите внимание на снижение эмиссии флуоресценции. (в) Контроль тех же клеток, растущих на минеральной среде с добавлением n -гексадекан (2% масс.:об.) и окрашен изотиоцианатом флуоресцеина. ( d ) Контроль тех же клеток, растущих на минеральной среде с добавлением d-фруктозы (2% вес: объем) и окрашенных изотиоцианатом флуоресцеина.
Клетки ANT-3b с помощью Nile Red, хромофора для нейтральных липидов, и его контроль с помощью неспецифического красителя, такого как изотиоцианат флуоресцеина. (а) Клетки, растущие на минеральной среде с добавлением н -гексадекана (2% масс.:об.) и окрашенные Нильским красным. ( б ) Клетки, растущие на минеральной среде с добавлением d-фруктозы (2% вес: объем) и окрашенные Нильским красным. Обратите внимание на снижение эмиссии флуоресценции. (в) Контроль тех же клеток, растущих на минеральной среде с добавлением n -гексадекан (2% масс.:об.) и окрашен изотиоцианатом флуоресцеина. ( d ) Контроль тех же клеток, растущих на минеральной среде с добавлением d-фруктозы (2% вес: объем) и окрашенных изотиоцианатом флуоресцеина.
Адгезию штамма ANT-3b к n -гексадекану также исследовали с помощью оптического микроскопа, наблюдая колонизацию капель масла и нарушение границы раздела масло-вода гликолипидом (рис. 5(а)). Морфология Halomonas sp. Клетки ANT-3b, растущие на n -гексадекан также определяли с помощью ПЭМ-анализа и сравнивали с растениями, растущими на d-фруктозе, источнике углерода и энергии, не способном индуцировать эмульгатор. Клетки, растущие на d-фруктозе, имели четко выраженную палочковидную форму (рис. 5(б)). Напротив, клетки, растущие на н -гексадекане, имели плохо выраженную морфологию и ореол внеклеточного материала. Клетки были настолько набухшими, что напоминали кокки (рис. 5 (с)). ТЭМ также показала, что гликолипид обильно секретировался в среде, и капли углеводорода были четко видны, что свидетельствует о сниженном поверхностном натяжении капель масла (рис. 5(d)). При ближайшем рассмотрении между маслом и гликолипидом была очевидна область контакта композиционного материала (рис. 5 (д)). Часть этого материала была окружена типичной текстурой, что можно объяснить наличием мезофаз [21].
Клетки, растущие на d-фруктозе, имели четко выраженную палочковидную форму (рис. 5(б)). Напротив, клетки, растущие на н -гексадекане, имели плохо выраженную морфологию и ореол внеклеточного материала. Клетки были настолько набухшими, что напоминали кокки (рис. 5 (с)). ТЭМ также показала, что гликолипид обильно секретировался в среде, и капли углеводорода были четко видны, что свидетельствует о сниженном поверхностном натяжении капель масла (рис. 5(d)). При ближайшем рассмотрении между маслом и гликолипидом была очевидна область контакта композиционного материала (рис. 5 (д)). Часть этого материала была окружена типичной текстурой, что можно объяснить наличием мезофаз [21].
5
Открыть в новой вкладкеСкачать слайд
(a) Изображение светового микроскопа (режим пропускания) Halomonas sp. Клетки ANT-3b прилипают к капле н -гексадекана и прорываются через границу раздела вода-нефть (стрелка). (b) Трансмиссионная электронная микрофотография Halomonas sp. Клетки ANT-3b, растущие в минеральной среде с добавлением d-фруктозы. (c) Трансмиссионная электронная микрофотография Halomonas sp. Клетки ANT-3b, растущие в минеральной среде с добавлением н -гексадекан. Обратите внимание на набухшую форму (напоминающую кокк) и внеклеточный ореол (стрелка). (г) Взаимодействие гликолипида с диспергированными каплями н -гексадекана разного размера (стрелки). ( e ) Деталь взаимодействия гликолипида / n -гексадекана с образованием квазиупорядоченной структуры смешанного гликолипида и гексадекана.
Клетки ANT-3b, растущие в минеральной среде с добавлением d-фруктозы. (c) Трансмиссионная электронная микрофотография Halomonas sp. Клетки ANT-3b, растущие в минеральной среде с добавлением н -гексадекан. Обратите внимание на набухшую форму (напоминающую кокк) и внеклеточный ореол (стрелка). (г) Взаимодействие гликолипида с диспергированными каплями н -гексадекана разного размера (стрелки). ( e ) Деталь взаимодействия гликолипида / n -гексадекана с образованием квазиупорядоченной структуры смешанного гликолипида и гексадекана.
4 Обсуждение
Мы выделили бактерию, которая растет на н-алкане благодаря новому эмульгатору, который он производит. Эта способность важна для выживания в холодных условиях, когда биодоступность углеводородов резко падает из-за их затвердевания. Секреция эмульгатора, продуцируемого адаптированной к холоду бактерией, может также стимулировать другие микроорганизмы к питанию углеводородами при низкой температуре. Различные гаммапротеобактерии обладают способностью продуцировать молекулы биосурфактанта. Например, род Pseudomonas продуцирует рамнолипиды, которые содержат биосурфактанты, содержащие рамнозу и β-гидроксидекановую кислоту [22,23]. Утверждается, что синтез этих молекул связан с производством альгината [24]. Рамнолипиды представляют собой амфифильные поверхностно-активные гликолипиды, обычно секретируемые в среде [25, 26], и они могут найти применение в борьбе с загрязнением моря нефтью, особенно при удалении нефти из песка [27].
Различные гаммапротеобактерии обладают способностью продуцировать молекулы биосурфактанта. Например, род Pseudomonas продуцирует рамнолипиды, которые содержат биосурфактанты, содержащие рамнозу и β-гидроксидекановую кислоту [22,23]. Утверждается, что синтез этих молекул связан с производством альгината [24]. Рамнолипиды представляют собой амфифильные поверхностно-активные гликолипиды, обычно секретируемые в среде [25, 26], и они могут найти применение в борьбе с загрязнением моря нефтью, особенно при удалении нефти из песка [27].
Различные другие эмульгирующие молекулы, продуцируемые гаммапротеобактериями, представляют собой липополисахарид, эмульсан [28,29] и гликопротеин аласан [30,31], выделенный из различных видов Acinetobacter . Недавно у другой гаммапротеобактерии Alcanivorax borkumensis была обнаружена новая активность сурфактанта [32]. Он содержит глицин и β-глюкопиранозид, этерифицированные 3-гидроксигексановой, -октановой и декановой кислотами, но имеет меньшую молекулярную массу, чем продуцируемый штаммом ANT-3b. К сожалению, сложная молекулярная структура гликолипида еще не решена с помощью анализа ЯМР-спектроскопии.
К сожалению, сложная молекулярная структура гликолипида еще не решена с помощью анализа ЯМР-спектроскопии.
Halomonas sp. ANT-3b представляет собой адаптированную к холоду гаммапротеобактерию, которая продуцирует эмульгирующий гликолипид в присутствии n -гексадекана. Определение вида было необходимо, чтобы оценить, был ли это новый вид или другие известные штаммы того же вида антарктического происхождения. Наибольшее сходство (99,8%) было с H. neptunia sp. ноябрь изолированы от глубоководных [19]. Общая линия штамма ANT-3b по данным филогенетического анализа [33] с H. neptunia и антарктических галомонад ANT9112 и SW04.
Точка ветвления штамма ANT-3b была стабильной, так как соответствующее значение начальной загрузки составляло 100%. Очень похожее дерево было построено с использованием алгоритма Джукса-Кантора (данные не показаны). Однако штамм ANT-3b существенно отличался по физиолого-биохимическим свойствам от нового вида H. neptunia [19].
neptunia [19].
Штамм ANT-3b, выделенный из этого района, проявляет психротолерантное поведение, растет на n -гексадекан в качестве единственного источника углерода и энергии при 4 °C с оптимумом при 15 °C, тогда как при 30 °C роста не обнаружено. Поскольку известно, что в строго аэробных условиях n -гексадекан разлагается n -алканмоноксигеназой, не было сочтено необходимым установить его присутствие. Однако необходимы дальнейшие исследования генов и ферментов штамма ANT-3b, участвующих в деградации алифатических углеводородов, даже несмотря на то, что пока известно, что только оперон alk кодирует n -алканодеградирующие ферменты строго аэробных бактерий [34].
Химическая характеристика гликолипида показала, что он содержит как насыщенные, так и ненасыщенные жирные кислоты с различной длиной цепи [35,36]. Каприловая кислота (C 8:0 ), по-видимому, является наиболее распространенной, за ней следуют пальмитиновая (C 16:0 ) и пальмитолеиновая (C 16:1 ) кислоты. О присутствии короткоцепочечных жирных кислот, таких как каприловая, в гликолипидах сообщается редко [32]. Вариабельность длины жирных кислот предположительно связана со своеобразной способностью Halomonas sp. ANT-3b эмульгирует н -гексадекан при низких температурах, но его также можно получить из-за присутствия нескольких гликолипидов. Гликолипиды с обычными длинноцепочечными жирными кислотами, по-видимому, легче претерпевают липидный фазовый переход, теряя свою эмульгирующую способность. Хотя молекулярная структура всего гликолипида еще не определена, его состав и функции вызывают ряд вопросов об адаптации этого штамма к условиям окружающей среды с низкой температурой и масляным сырьем. Особая длина цепи, возможно, может защитить целостность и функцию клеточной мембраны [37]. Контакт масло-гликолипид на границе раздела органической и водной фаз имеет жидкокристаллическую двулучепреломляющую структуру [21]. Температурная стабильность подвижной липидной фазы представляет интерес и в связи со своеобразным асимметричным составом гликолипидного компонента.
О присутствии короткоцепочечных жирных кислот, таких как каприловая, в гликолипидах сообщается редко [32]. Вариабельность длины жирных кислот предположительно связана со своеобразной способностью Halomonas sp. ANT-3b эмульгирует н -гексадекан при низких температурах, но его также можно получить из-за присутствия нескольких гликолипидов. Гликолипиды с обычными длинноцепочечными жирными кислотами, по-видимому, легче претерпевают липидный фазовый переход, теряя свою эмульгирующую способность. Хотя молекулярная структура всего гликолипида еще не определена, его состав и функции вызывают ряд вопросов об адаптации этого штамма к условиям окружающей среды с низкой температурой и масляным сырьем. Особая длина цепи, возможно, может защитить целостность и функцию клеточной мембраны [37]. Контакт масло-гликолипид на границе раздела органической и водной фаз имеет жидкокристаллическую двулучепреломляющую структуру [21]. Температурная стабильность подвижной липидной фазы представляет интерес и в связи со своеобразным асимметричным составом гликолипидного компонента. Интерференционная картина требует микроскопического и дифрактометрического анализа in vitro текстуры смешанной липидной фазы с целью характеристики этих мезофазных структур [21].
Интерференционная картина требует микроскопического и дифрактометрического анализа in vitro текстуры смешанной липидной фазы с целью характеристики этих мезофазных структур [21].
Необходим комментарий относительно макромолекулярных характеристик гликолипидов. Его молекулярная масса, хотя и требует подтверждения более строгими методами определения молекулярной массы (например, светорассеянием), указывает на то, что гликолипид находится в диапазоне 10 4 Дальтон. Это сильно отличается от размеров большинства известных гликолипидов сурфактанта [38], которые содержат либо дисахариды (рамнозу, трегалозу, целлобиозу), либо полисахариды, такие как эмульсан или липозан [5]. Размеры гликолипида от Halomonas sp. ANT-3b весьма сходны с таковыми некоторых О-антигенных полисахаридов, ассоциированных с ядром ЛПС грамотрицательных микроорганизмов [20]. Хотя состав сахара указывает на некоторое сходство с липоолигосахаридной фракцией психрофильного Pseudoalteromonas haloplanktis TAC 125 [7,8], молекулярная масса двух липоолигосахаридов (2134 и 2332) явно намного меньше, чем определено здесь. Можно сделать вывод, что от восьми до десяти таких единиц связаны в том, что можно считать синергетическим эмульгатором.
Можно сделать вывод, что от восьми до десяти таких единиц связаны в том, что можно считать синергетическим эмульгатором.
В случае Pseudoalteromonas haloplanktis TAC 125 предполагается возможное присутствие как липоолигосахаридов, так и липополисахаридов разной молекулярной массы, но, возможно, сходного состава [7]. Может быть важно знать, следует ли продукция этих макромолекул отдельным метаболическим линиям или возникает в результате дифференцировки во внеклеточной постсинтезной полимеризации. Подобные проблемы действительно возникали при изучении полисахаридов родов Rhizobium и Agrobacterium , что привело Zevenhuizen [39] к предложению общего пути биосинтеза двух разных полисахаридов, образующихся в связи с различными условиями окружающей среды.
Благодарности
Это исследование финансировалось проектом PNRA 1999–2003 (Progetto Nazionale Ricerche in Antartide). Авторы благодарят Михаила Якимова за филогенетическое дерево и предложения по рукописи. Они также благодарят Клаудию Фалери за анализ ПЭМ.
Они также благодарят Клаудию Фалери за анализ ПЭМ.
Каталожные номера
[1]
Бил
Р.
Беттс
В.Б.
(
2000
)
Роль рамнолипидов биосурфактантов в поглощении и минерализации гексадекана в Pseudomonas aeruginosa
.
Дж. Заявл. Микробиол
.
89
,
158
–
168
.
[2]
Кох
А.К.
Каппели
О.
Фихтер
А.
Райзер
Дж.
(
1991
)
Усвоение углеводородов и продукция биосурфактантов у мутантов Pseudomonas aeruginosa
.
Дж. Бактериол
.
173
,
4212
–
4219
.
[3]
Чжан
Ю.
Миллер
Р.М.
.
Заявл. Окружающая среда. Микробиол
.
58
,
3276
–
3282
.
[4]
Майер
Р.М.
(
2003
)
Биосурфактанты: эволюция и разнообразие бактерий
.
Доп. заявл. Микробиол
.
52
,
101
–
121
.
[5]
Десаи
J.D.
Banat
I.M.
(
1997
)
Микробное производство поверхностно-активных веществ и их коммерческий потенциал
.
Микробиолог. Мол. биол.
.
61
,
47
–
64
.
[6]
Baraniecki
C.A.
Айлаби
Дж.
Фогт
Дж.М.
(
2002
)
Характеристика Sphingomonas sp. Ant 17, бактерия, разлагающая ароматические углеводороды, выделенная из антарктической почвы
.
Микроб. Экол
Экол
.
43
,
44
–
54
.
[7]
Corsaro
М.М.
Lanzetta
R.
Parrilli
E.
Parrilli
M.
Tutino
M.L.
(
2001
)
Структурное исследование липоолигосахаридной фракции психрофильной бактерии Pseudoalteromonas haloplanktis TAC 125
.
Евро. Дж. Биохим
.
268
,
5092
–
5097
.
[8]
Corsaro
М.М.
Lanzetta
R.
Parrilli
E.
Parrilli
M.
Tutino
M.L.
Аммарино
С.
(
2004
)
Влияние температуры роста на содержание липидов и фосфатов в поверхностных полисахаридов антарктической бактерии Pseudoalteromonas haloplanktis TAC 125
.
Дж. Бактериол
.
186
,
29
–
34
.
[9]
Уайт
Л.Г.
Слагман
С.Дж.
Пьетрантонио
Ф.
Бурбоньерка
Л.
Коваль
С.Ф.
Лоуренс
J.R.
Inniss
W.E.
Грир
CW
(
1999
)
Физиологические адаптации при низкотемпературном окислении аканов Rhodococcus sp. штамм Q15
штамм Q15
.
Заявл. Окружающая среда. Микробиол
.
65
,
2961
–
2968
.
[10]
Якимов
М.М.
Джулиано
Л.
Джентиле
Г.
Крисафи
Э.
Черникова
Т.Н.
Абрахам
W.R.
Лунсдорф
Х.
Тиммис
К.Н.
Голышин
П.Н.
(
2003
)
Olespira antarctica род. ноябрь, сп. nov., новая гидроокластическая морская бактерия, выделенная из прибрежной морской воды Антарктики
.
Междунар. Дж. Сист. Эвол. Микро
.
53
,
779
–
785
.
[11]
Брэдфорд
М.М.
(
1976
)
Быстрый и чувствительный метод количественного определения количества белка в микрограммах, использующий принцип связывания белка с красителем
.
Анал. Биохим
.
72
,
248
–
254
.
[12]
Altschul
S.F.
Мэдден
Т.Л.
Schäffer
А.А.
Чжан
Дж.
Чжан
З.
Миллер
В.
Липман
Д. Дж.
Дж.
(
1997
)
Gapped BLAST и PSI-BLAST: новое поколение программ поиска белков в базе данных
.
Рез. нуклеиновых кислот
.
25
,
3389
–
3402
.
[13]
Сайтоу
Н.
(
1987
)
Метод объединения соседей: новый метод реконструкции филогенетических деревьев
.
Мол. биол. Эвол
.
4
,
406
–
425
.
[14]
Блэкни
А.Б.
Харрис
П.Дж.
Генри
Р.Дж.
Камень
Б.А.
(
1983
)
Простой и быстрый препарат ацетатов альдита для анализа моносахаридов
.
Углевод. Рез
.
113
,
291
–
299
.
[15]
АОАС
(
1990
)
Официальные методы анализа
15-е изд.
AOAC International
США
.
[16]
Baldi
F.
IVOSEVIC
N.
MINACCI
A.
PEPI
M.
R.
SVETLICIC
59.
4.
.
59.
.
.
v…
9.
В.
(
1999
)
Адгезия Acinetobacter venetianus к каплям дизельного топлива, изученным с помощью электрохимических и молекулярных зондов in situ
.
Заявл. Окружающая среда. Микробиол
.
65
,
2041
–
2048
.
[17]
Майдак
Б.Л.
Олсен
Г.Дж.
Larsen
N.
Overbeek
R.
McCaughey
M.J.
Woese
CR
(
1997
)
RDP (Проект рибосомной базы данных)
.
Рез. нуклеиновых кислот
.
25
,
109
–
111
.
[18]
Гутель
Р.Р.
(
1994
)
Коллекция структур малых субъединиц (16S- и 16S-подобных) рибосомных РНК
.
Рез. нуклеиновых кислот
.
22
,
3502
–
3507
.
[19]
Кей
Дж.К.
Маркес
М.К.
Ventosa
A.
Baross
J.A.
(
2004
)
Halomonas neptunia sp. nov., Halomonas sulfidaeris sp. nov., Halomonas axiensis sp. ноябрь и Halomonas hydrothermalis сп. ноябрь галофильные бактерии, выделенные из глубоководных гидротермальных источников
nov., Halomonas sulfidaeris sp. nov., Halomonas axiensis sp. ноябрь и Halomonas hydrothermalis сп. ноябрь галофильные бактерии, выделенные из глубоководных гидротермальных источников
.
Междунар. Дж. Сист. Эвол. Микро
.
54
,
499
–
511
.
[20]
Kjellberg
A.
Weintraub
A.G.W.
(
1999
)
Структурное определение и биосинтетические исследования О-антигенного полисахарида из энтерогеморрагических Escherichia coli O91 с использованием C-13-обогащения и ЯМР-спектроскопии
.
Биохимия
38
,
12205
–
12211
.
[21]
До свидания
J.W.
Мел
Г.Х.
Saez
I.M.
Tuffin
R.P.
Mackenzie
G.
Auzely-velty
R.
Benvegnu
T.
R.0005
Plusquellec
Д.
(
1998
)
Жидкие кристаллы с ограниченной молекулярной топологией: супермолекулы и супрамолекулярные сборки
.
Хим. Коммуна
.
19
,
2057
–
2070
.
[22]
Lang
S.
Wullbrandt
D.
(
1999
)
Биосинтез липидов рамнозы, микробная продукция и возможности применения
.
Заявл. микробиол. Биотехнолог
.
51
,
22
–
32
.
[23]
Окснер
U.A.
Хембах
Т.
Фихтер
А.
(
1996
)
Производство рамнолипидов биосурфактантов
.
Доп. Биохим. англ. Биотехнолог
.
53
,
89
–
118
.
[24]
Olvera
C.
Goldberg
J.B.
Sanchez
R.
Soberon-Chavez
G.
(
1999
)
Продукт гена Pseudomonas aeruginosa algC участвует в биосинтезе рамнолипидов
.
ФЭМС микробиол. Письмо
.
179
,
85
–
90
.
[25]
Эллаия
П.
Прабхакар
Т.
Шрикант
М.
Талеб
5
Раджу
П.Б.
Саиша
В.
(
2002
)
Производство гликолипидов, содержащих биосурфактант по Pseudomonas вид
.
Indian J. Exp. Биол
.
40
,
1083
–
1086
.
[26]
Тулева
Б.К.
Иванов
Г. Р.
Р.
Христова
Н.В.
(
2002
)
Производство биосурфактанта новым штаммом Pseudomonas putida
.
Z. Натурфорш. (С]
57
,
356
–
360
.
[27]
Рахман
К.С.
Рахман
Т.Дж.
McClean
S.
Marchant
R.
Banat
I.M.
(
2002
)
Производство биосурфактанта рамнолипидов штаммами Pseudomonas aeruginosa с использованием дешевого сырья
.
Биотехнология. Прог
.
18
,
1277
–
1281
.
[28]
Бах
Х.
Бердичевский
Ю.
Гутник
Д.Л.
(
2003
)
Экзоклеточный белок микроба, разлагающего нефть Acinetobacter venetianus RAG-1 усиливает эмульгирующую активность полимерного биоэмульгатора эмульсана
.
Заявл. Окружающая среда. Микробиол
.
69
,
2608
–
2615
.
[29]
Розенберг
Э.
Рон
Э.З.
(
1997
)
Биоэмульгаторы: микробные полимерные эмульгаторы
.
Курс. мнение Биотехнолог
мнение Биотехнолог
.
8
,
313
–
316
.
[30]
Navon-Venezia
S.
Zosim
Z.
Gottlieb
A.
Legman
R.
Carmeli
S.
Ron
E.Z.
Розенберг
Э.
(
1995
)
Alasan, новый биоэмульгатор из Acinetobacter radioresistens
.
Заявл. Окружающая среда. Микробиол
.
61
,
3240
–
3244
.
[31]
Торен
А.
Пайтан
Ю.
Рон
Э.З.
Розенберг
Э.
(
2002
)
Активный компонент биоэмульгатора аласан из Acinetobacter radioresistens КА53 представляет собой OmpA-подобный белок
.
J. Бактериол
.
184
,
165
–
170
.
[32]
Абрахам
В.
Мейер
Х.
Якимов
М.М.
(
1998
)
Новый глицин, содержащий гликолипиды из алкана с использованием бактерии Alcanivorax borkumensis
.
Биохим. Биофиз. Акта
Акта
1393
,
57
–
62
.
[33]
Анзай
Ю.К.Х.
Парк
Дж.Ю.
Вакабаяси
Х.
Ояйдзу
Х.
(
2000
)
Филогенетическая принадлежность псевдомонад на основе последовательности 16S рРНК
.
Междунар. Дж. Сист. Эвол. Микробиол
.
50
,
1563
–
1589
.
[34]
Фомберг
А.
Клиннер
У.
.
Дж. Заявл. Микробиол
.
89
,
339
–
348
.
[35]
Бранденбург
К.
Andrä
J.
Müller
M.
Koch
M.H.J.
Гаридель
П.
(
2003
)
Физико — химические свойства бактериальных гликополимеров в зависимости от биоактивности
.
Углевод. Рез
.
338
,
2477
–
2489
.
[36]
Карофф
М.
Карибский
Д.
(
2003
)
Структура бактериальных липополисахаридов
.
Углевод. Рез
.
338
,
2431
–
2447
.
[37]
Якимов
М.М.
Джулиано
Л.
Бруни
В.
Скарфи
С.
Голышин
П.Н.
(
1999
)
Характеристика антарктических углеводородоразрушающих бактерий, способных производить биоэмульгаторы
.
Нью Микробиол
.
22
,
249
–
256
.
[38]
Назаренко
Е.Л.
Командрова
Н. А.
А.
Горшкова
Р.П.
Томшич
С.В.
Зубков
В.А.
Килкойн
М.
Сэвидж
А.В.
(
2003
)
Структуры полисахаридов и олигосахаридов некоторых грамотрицательных морских протеобактерий
.
Углевод. Рез
.
338
,
2449
–
2457
.
[39]
Zevenhuizen
L.P.T.M.
Разнообразие синтеза полисахаридов в ограниченной группе бактерий
Crescenzi
V.
Paoletti
S.
Stivala
S.S.
, Ред.
Биомедицинские и биотехнологические достижения в области промышленных полисахаридов
1989
,
Издательство Gordon and Breach Science Publishers
,
301
10009 –
0005
.
© Федерация европейских микробиологических обществ, 2005 г. Опубликовано Elsevier B.V. Все права защищены.
© Федерация европейских микробиологических обществ, 2005 г. Опубликовано Elsevier B.V. Все права защищены.
Заявка на патент США на УСТРОЙСТВО ДЛЯ УПРАВЛЕНИЯ СУДНОМ Заявка на патент (заявка № 20140174331 от 26 июня 2014 г.)
УРОВЕНЬ ТЕХНИКИ
Условно известно судно, имеющее стационарный двигатель (бортовой двигатель, подвесной привод), в котором пара левого и правого двигателей расположены внутри корпуса, а мощность передается паре левого и правого выводные устройства, расположенные вне корпуса. Выносные устройства представляют собой движители, вращающие гребные винты для приведения корпуса в движение, и представляют собой рули направления, вращаемые относительно направления движения корпуса, чтобы заставить корпус поворачиваться.
Такие наружные приводы вращаются с помощью гидравлических рулевых приводов, предусмотренных в выходных устройствах (например, см. патентную литературу 1). Затем угол поворота каждого из выходных устройств, то есть угол поворота, фиксируется на основе результатов обнаружения датчика определения угла и т.п., предусмотренного в рычажном механизме, составляющем выходное устройство.
патентную литературу 1). Затем угол поворота каждого из выходных устройств, то есть угол поворота, фиксируется на основе результатов обнаружения датчика определения угла и т.п., предусмотренного в рычажном механизме, составляющем выходное устройство.
Судно имеет средства управления, задающие направление движения корабля. Корабль управляется устройством управления таким образом, чтобы двигаться в направлении, заданном с помощью средств управления.
ССЫЛКА НА ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ Патентная литература
Патентная литература 1: Японский патентный бюллетень Hei. 1-285486
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ Задачи, решаемые изобретением
Рабочее средство имеет блок определения наклонной составляющей парусности и блок определения составляющей поворота. Обычно, когда блок определения наклонной составляющей парусности и блок определения составляющей поворота работают одновременно, приоритет не устанавливается и действие корпуса является неестественным, в результате чего плавное маневрирование не может быть выполнено.
Принимая во внимание вышеуказанные проблемы, цель настоящего изобретения состоит в том, чтобы предоставить устройство управления судном, которое может повысить чувствительность операции и обеспечить плавную работу при одновременной работе блока определения наклонной составляющей парусности и блока определения составляющей поворота операционного средства. .
Средства для решения проблем
Проблемы, которые должны быть решены с помощью настоящего изобретения, были описаны выше, и впоследствии средства решения проблем будут описаны ниже.
Согласно настоящему изобретению судовое маневренное устройство содержит пару левого и правого двигателей, исполнительные механизмы изменения скорости вращения, независимо изменяющие скорость вращения пары левого и правого двигателей, пару левого и правого выходных приводов, соответственно соединенных с пара левого и правого двигателей и вращающихся гребных винтов для приведения в движение корпуса, переключающие муфты прямого/обратного хода, расположенные между двигателями и гребными гребными винтами, пара левого и правого рулевых приводов соответственно независимо вращают пару левого и правого выходных приводов устройства в поперечном направлении в пределах заданного диапазона углов, средство управления, устанавливающее направление движения судна, средство определения количества операций, определяющее количество операций средств управления, и устройство управления, управляющее исполнительными механизмами изменения скорости вращения, муфтами переключения прямого/обратного хода , и приводы рулевого управления, чтобы двигаться в направлении, заданном средствами управления . Управляющее устройство вычисляет векторы тяги наклонной парусной составляющей для наклонного движения левого и правого выходных устройств и векторы тяги поворотной составляющей для разворота по величине работы исполнительных средств и составляет векторы тяги наклонной парусной составляющей и поворотной составные векторы тяговой силы левого и правого приводных устройств для расчета векторов состава, тем самым вычисляя тяговые мощности и направления левого и правого выходных устройств.
Управляющее устройство вычисляет векторы тяги наклонной парусной составляющей для наклонного движения левого и правого выходных устройств и векторы тяги поворотной составляющей для разворота по величине работы исполнительных средств и составляет векторы тяги наклонной парусной составляющей и поворотной составные векторы тяговой силы левого и правого приводных устройств для расчета векторов состава, тем самым вычисляя тяговые мощности и направления левого и правого выходных устройств.
В соответствии с настоящим изобретением, когда направления вектора состава находятся в пределах диапазона, превышающего заданный диапазон углов выходного устройства, выходное устройство управляется таким образом, чтобы перевести его в режим заданного предельного угла, и скорость вращения двигателя снижается. до заданной скорости вращения.
В соответствии с настоящим изобретением, когда направление вектора состава находится в пределах заданного диапазона углов выходного устройства, угол поворота выходного устройства фиксируется в состоянии заданного предельного угла.
В соответствии с настоящим изобретением, когда направление вектора композиции находится в пределах диапазона, превышающего заданный диапазон углов выходного устройства, скорость вращения двигателя снижается после уменьшения малого угла между направлением композиции вектор и поперечное направление корпуса.
Эффект изобретения
Настоящее изобретение обеспечивает следующие эффекты.
В соответствии с настоящим изобретением, по сравнению со случаем расчета сил тяги и направлений левого и правого выносных движителей на основе только векторов сил тяги наклонной парусной составляющей с последующим вычислением сил тяги и направлений левого и устройства правой выносной передачи, основанные только на векторах тяги поворотного компонента, путем вычисления векторов состава на основе векторов тяги наклонного парусного компонента и векторов тяги поворотного компонента, достигается плавность работы и улучшается работоспособность. Поскольку тяговая мощность наклонного парусного компонента и тяговая мощность поворотного компонента могут управляться независимо, эти компоненты не мешают друг другу, в результате чего поворотный момент, создаваемый во время операции поворота, всегда имеет одни и те же характеристики независимо от входного сигнала косая парусная операция. Соответственно, у корабля с таким управлением повышается точность коррекции направления поворота.
Поскольку тяговая мощность наклонного парусного компонента и тяговая мощность поворотного компонента могут управляться независимо, эти компоненты не мешают друг другу, в результате чего поворотный момент, создаваемый во время операции поворота, всегда имеет одни и те же характеристики независимо от входного сигнала косая парусная операция. Соответственно, у корабля с таким управлением повышается точность коррекции направления поворота.
В соответствии с настоящим изобретением, даже если направление вектора состава выходит за заданный диапазон углов выходного устройства, управление выходным устройством может быть скорректировано.
Согласно настоящему изобретению, когда направление вектора состава выходит за заданный диапазон углов выходных устройств, предотвращается частое изменение угла поворота и частое переключение прямого/обратного вращения выходного устройства.
Согласно настоящему изобретению, когда направление вектора состава выходит за заданный диапазон углов выходных устройств, переключение прямого/обратного вращения выходных устройств может выполняться плавно.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
РИС. 1 представляет собой чертеж корабля согласно варианту осуществления настоящего изобретения.
РИС. 2 представляет собой частичный вид слева в разрезе выходного устройства в соответствии с вариантом осуществления настоящего изобретения.
РИС. 3 представляет собой частичный вид справа в разрезе выходного устройства в соответствии с вариантом осуществления настоящего изобретения.
РИС. 4 представляет собой чертеж рабочего устройства.
РИС. 5 представляет собой блок-схему устройства управления.
РИС. 6 представлена блок-схема метода расчета тяговых мощностей и направлений левого и правого приводных устройств.
РИС. 7(A) представляет собой чертеж векторов мощности наклонного парусного компонента тяги выходных устройств. ИНЖИР. 7(B) представляет собой чертеж векторов тяговой мощности компонентов поворота устройств с выходной передачей. ИНЖИР. 7(C) представляет собой рисунок векторов композиции выходных устройств.
ИНЖИР. 7(C) представляет собой рисунок векторов композиции выходных устройств.
РИС. 8 представляет собой вид сверху на угол поворота выходного устройства.
РИС. 9 представляет собой график зависимости угла вектора композиции от угла поворота выходного устройства.
РИС. 10 — вид сверху на угол поворота выходного устройства.
РИС. 11 представляет собой график зависимости угла поворота выходного устройства от скорости снижения скорости вращения двигателя.
ОПИСАНИЕ ОБОЗНАЧЕНИЙ
1 Устройство маневрирования корабля
2 HULL
3 A и 3 B Двигатели
.
15 A и 15 B винтовые пропеллеры
16 A и 16 B Forward/обратный переключатель
17 A и 17
17 A и 17
17 A и 17
17 A и 17
0005
21 джойстика (операционные средства)
31 Устройство управления
39 ОБЩЕСТВЕННЫЕ СТАВИТЕЛЬНЫЕ ДАТЧИКА

.
T Arot и T Brot векторы мощности поворотного элемента
T A и T B вектора состава
β углы векторов состава
θ A и θ B углы поворота выносных устройств
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Прежде всего, будет дано объяснение устройства управления судном согласно варианту осуществления настоящего изобретения.
Как показано на РИС. 1, 2 и 3 , судовое маневровое устройство 1 имеет пару левого и правого двигателей 3 А и 3 Б, приводы изменения скорости вращения 4 А и 4 Б с независимым изменением частоты вращения двигателей N А и N Б пары левого и правого двигателей 3 А и 3 Б, пары левого и правого выходных устройств 10 A и 10 B, соединенные соответственно с парой левого и правого двигателей 3 A и 3 B и вращающимися винтовыми гребными винтами 15 A и 15 B, чтобы приводить в движение корпус
8 2 92 Муфты переключения вперед/назад 16 А и 16 Б, расположенные между двигателями 3 А и 3 Б и гребными винтами 15 А и 15 Б, пара левого и правого гидроприводов рулевого управления 17 А 17 B соответственно независимо вращающие пару левого и правого передних приводов 10 A и 10 B в боковом направлении, электромагнитные клапаны 17 Aa и 17 Ba, регулирующие гидравлическое давление в гидравлических приводах рулевого управления 17 A и 17 B, джойстик 21 , рычаги акселератора 22 A и 22 B и штурвал управления 23 в качестве операции установка направления движения судна, датчик определения количества операций 39 (см. фиг. 5) в качестве средства определения количества операций, определяющих количество операций джойстика 21 , датчик определения количества операций 43 A и 43 B (см. фиг. 5) в качестве средств определения количества операций определение количества операций рычагов акселератора 22 A и 22 B, датчик 44 определения количества операций (см. фиг. 5) в качестве средства определения количества операций, определяющий количество операций рабочего колеса 23 , и устройство 31 управления ( см. рис.5) управление приводами изменения скорости вращения 4 А и 4 Б, муфтами переключения переднего/заднего хода 16 А и 16 Б, гидроприводами рулевого управления 17 А и 17 B и электромагнитные клапаны 17 Aa и 17 Ba, чтобы двигаться в направлении, заданном джойстиком 21 , рычагами акселератора 22 A и 22 B и рабочим колесом
фиг. 5) в качестве средства определения количества операций, определяющих количество операций джойстика 21 , датчик определения количества операций 43 A и 43 B (см. фиг. 5) в качестве средств определения количества операций определение количества операций рычагов акселератора 22 A и 22 B, датчик 44 определения количества операций (см. фиг. 5) в качестве средства определения количества операций, определяющий количество операций рабочего колеса 23 , и устройство 31 управления ( см. рис.5) управление приводами изменения скорости вращения 4 А и 4 Б, муфтами переключения переднего/заднего хода 16 А и 16 Б, гидроприводами рулевого управления 17 А и 17 B и электромагнитные клапаны 17 Aa и 17 Ba, чтобы двигаться в направлении, заданном джойстиком 21 , рычагами акселератора 22 A и 22 B и рабочим колесом
193 9.
Двигатели 3 A и 3 B расположены в задней части корпуса 2 парой сбоку и соединены с выходными устройствами 10 A и 10 B, расположенными снаружи судна . Двигатели 3 A и 3 B имеют выходные валы 41 A и 41 B для передачи мощности вращения.
Приводы изменения скорости вращения 4 A и 4 B являются средствами управления мощностью вращения двигателя и изменяют количество впрыска топлива устройства впрыска топлива и т.п. для управления скоростью вращения двигателей 3 A и 3 B.
Выносные устройства 10 A и 10 B представляют собой движители, вращающие винтовые гребные винты 15 A и 15 B для приведения в движение корпуса 2 , и расположены снаружи задней части корпуса 2 в виде пары сбоку. Пара левого и правого передних приводов 10 A и 10 B соответственно соединены с парой левого и правого двигателей 3 A и 3 B. Передние приводы 10 A и 10 B представляют собой рулевые устройства, которые вращаются относительно направления движения корпуса 2 , чтобы повернуть корпус 2 . Обгонные устройства 10 А и 10 Б в основном включают первичные валы 11 А и 11 Б, муфты переключения переднего/заднего хода 16 А и 16 А и 16 А, приводные валы 1 1 13 B, выходной вал 14 A и 14 B и гребные винты 15 A и 15 B.
Пара левого и правого передних приводов 10 A и 10 B соответственно соединены с парой левого и правого двигателей 3 A и 3 B. Передние приводы 10 A и 10 B представляют собой рулевые устройства, которые вращаются относительно направления движения корпуса 2 , чтобы повернуть корпус 2 . Обгонные устройства 10 А и 10 Б в основном включают первичные валы 11 А и 11 Б, муфты переключения переднего/заднего хода 16 А и 16 А и 16 А, приводные валы 1 1 13 B, выходной вал 14 A и 14 B и гребные винты 15 A и 15 B.
Первичные валы 11 A и 11 B передают мощность вращения. В деталях первичные валы 11 А и 11 Б передают мощность вращения двигателей 3 А и 3 Б, передаваемую от выходных валов 41 А и 41 Б двигателей 3 A и 3 B через карданные шарниры 5 A и 5 B, к муфтам переключения прямого/обратного хода 16 A и 16 B. Один из концов каждого из первичных валов 11 А и 11 Б соединяется с соответствующим одним из карданных шарниров 5 А и 5 Б, прикрепленных к выходным валам 41 А и 41 Б двигателей 1 А и
В деталях первичные валы 11 А и 11 Б передают мощность вращения двигателей 3 А и 3 Б, передаваемую от выходных валов 41 А и 41 Б двигателей 3 A и 3 B через карданные шарниры 5 A и 5 B, к муфтам переключения прямого/обратного хода 16 A и 16 B. Один из концов каждого из первичных валов 11 А и 11 Б соединяется с соответствующим одним из карданных шарниров 5 А и 5 Б, прикрепленных к выходным валам 41 А и 41 Б двигателей 1 А и
8 3 3 3 B, а другой конец соединен с соответствующей одной из муфт переключения прямого/обратного хода 16 A и 16 B.
Муфты переключения прямого/обратного хода 16 A и 16 B расположены между двигателями 3 A и 3 B и гребные винты 15 A и 15 B, и переключатель направления вращения мощности вращения. В частности, муфты переключения прямого/обратного хода 16 A и 16 B представляют собой устройства переключения направления вращения, которые переключают мощность вращения двигателей 3 A и 3 B, передаваемую через первичные валы 11 A. и 11 B и т.п., в прямом или обратном направлении. Муфты переключения переднего/заднего хода 16 А и 16 Б имеют конические шестерни переднего хода и конические шестерни заднего хода, которые соединены с внутренними барабанами, имеющими дисковые пластины, а нажимные пластины наружных барабанов, соединенные с входными валами 11 А и 11 Б, прижаты к дисковые пластины конических шестерен переднего хода или конических шестерен заднего хода, чтобы переключать направление вращения.
В частности, муфты переключения прямого/обратного хода 16 A и 16 B представляют собой устройства переключения направления вращения, которые переключают мощность вращения двигателей 3 A и 3 B, передаваемую через первичные валы 11 A. и 11 B и т.п., в прямом или обратном направлении. Муфты переключения переднего/заднего хода 16 А и 16 Б имеют конические шестерни переднего хода и конические шестерни заднего хода, которые соединены с внутренними барабанами, имеющими дисковые пластины, а нажимные пластины наружных барабанов, соединенные с входными валами 11 А и 11 Б, прижаты к дисковые пластины конических шестерен переднего хода или конических шестерен заднего хода, чтобы переключать направление вращения.
Приводные валы 13 A и 13 B передают мощность вращения. В частности, приводные валы 13 А и 13 В — валы вращения, которые передают мощность вращения двигателей 3 А и 3 В, передаваемую через муфты переключения прямого/обратного хода 16 А и 16 В и т.п. , к конечному выходному валу 14 A и 14 B. Коническая шестерня, установленная на одном из концов каждого из приводных валов 13 A и 13 B, находится в зацеплении с конической шестерней переднего и заднего хода. шестерня, предусмотренная на соответствующей одной из муфт переключения переднего/заднего хода 16 A и 16 B, а коническая шестерня на другом конце находится в зацеплении с конической шестерней на соответствующем концевом выходном валу 14 A и 14 B.
В частности, приводные валы 13 А и 13 В — валы вращения, которые передают мощность вращения двигателей 3 А и 3 В, передаваемую через муфты переключения прямого/обратного хода 16 А и 16 В и т.п. , к конечному выходному валу 14 A и 14 B. Коническая шестерня, установленная на одном из концов каждого из приводных валов 13 A и 13 B, находится в зацеплении с конической шестерней переднего и заднего хода. шестерня, предусмотренная на соответствующей одной из муфт переключения переднего/заднего хода 16 A и 16 B, а коническая шестерня на другом конце находится в зацеплении с конической шестерней на соответствующем концевом выходном валу 14 A и 14 B.
Конечный выходной вал 14 A и 14 B передают мощность вращения. В частности, конечные выходные валы 14 A и 14 B представляют собой валы вращения, которые передают мощность вращения двигателей 3 A и 3 B, передаваемую через приводные валы 9.2818 13 A и 13 B и т.п., к гребным винтам 15 A и 15 B. Как упоминалось выше, коническая шестерня предусмотрена на одном из концов каждого выходного вала 14 A. и 14 B входит в зацепление с коническим зубчатым колесом соответствующего одного из приводных валов 13 A и 13 B, а другой конец прикреплен к нему с соответствующим одним из гребных винтов 15 A и 15 B.
В частности, конечные выходные валы 14 A и 14 B представляют собой валы вращения, которые передают мощность вращения двигателей 3 A и 3 B, передаваемую через приводные валы 9.2818 13 A и 13 B и т.п., к гребным винтам 15 A и 15 B. Как упоминалось выше, коническая шестерня предусмотрена на одном из концов каждого выходного вала 14 A. и 14 B входит в зацепление с коническим зубчатым колесом соответствующего одного из приводных валов 13 A и 13 B, а другой конец прикреплен к нему с соответствующим одним из гребных винтов 15 A и 15 B.
Винты 15 A и 15 B вращаются для создания движущей силы. В частности, гребные винты 15 A и 15 B приводятся в движение мощностью вращения двигателей 3 A и 3 B, передаваемой через конечный выходной вал 14 A и 14 B и например, так что множество лопастей, расположенных вокруг вращающихся валов, гребут окружающую воду, в результате чего создается движущая сила.
Гидравлические приводы рулевого управления 17 A и 17 B представляют собой гидравлические устройства, приводящие в движение рулевые рычаги 18 A и 18 B, чтобы вращать передние приводы 10 A и 10 B. Гидравлические приводы рулевого управления 19 A и 17 B снабжены электромагнитными клапанами 17 Aa и 17 Ba для регулирования гидравлического давления, а электромагнитные клапаны 17 Aa и 17 Ba соединены с устройством управления 31 .
Гидравлические приводы рулевого управления 17 A и 17 B представляют собой так называемые одностержневые гидравлические приводы. Однако гидравлические приводы рулевого управления 17 A и 17 B в качестве альтернативы могут быть двухштокового типа.
Джойстик 21 как средство управления представляет собой устройство, определяющее направление движения судна, и расположен рядом с сиденьем оператора корпуса 2 . Плоская рабочая поверхность джойстика 21 представляет собой деталь 21 a, a, a, a, a, a, b, определяющую составляющую наклонного движения, а его рабочая поверхность кручения представляет собой деталь 21 b определения составляющего поворота.
Джойстик 21 можно свободно перемещать внутри рабочей поверхности параллельно плоскости X-Y, показанной на РИС. 4, а центр рабочей поверхности используется в качестве нейтральной начальной точки. Продольное и поперечное направления рабочей поверхности соответствуют направлению движения и величине наклона джойстика 9.2818 21 соответствует целевой скорости корпуса. Целевая скорость корпуса увеличивается в соответствии с увеличением угла наклона джойстика 21 .
Торсионная рабочая поверхность снабжена джойстиком 21 , и путем поворота джойстика 21 относительно оси Z, проходящей практически перпендикулярно плоской рабочей поверхности в качестве оси поворота, можно изменить скорость поворота. Величина кручения джойстика 21 соответствует заданной скорости поворота. Максимальная целевая скорость бокового поворота устанавливается при фиксированных положениях угла поворота джойстика 21 .
Рычаги акселератора 22 A и 22 B в качестве средств управления являются устройствами, определяющими целевую скорость корпуса судна, и расположены рядом с сиденьем оператора корпуса 2 . Два рычага акселератора 22 A и 22 B установлены таким образом, чтобы соответствовать соответственно левому и правому двигателям 3 A и 3 B. Скорость вращения двигателя 3 A изменяется с помощью рычаг акселератора 22 A, а скорость вращения двигателя 3 B изменяется с помощью рычага акселератора 22 B.
Рабочее колесо 23 как средство управления является устройством, определяющим направление движения судна , и предусмотрен рядом с местом оператора корпуса 2 . Направление движения широко изменяется после увеличения числа оборотов рабочего колеса 23 .
А Выключатель пуска управления коррекцией 42 (см. рис. 5) — переключатель для включения управления коррекцией поворота корпуса 2 .
Переключатель запуска управления коррекцией 42 расположен рядом с джойстиком 21 и соединен с устройством управления 31 .
Далее будет дано объяснение различных видов средств обнаружения со ссылкой на фиг. 5.
Датчики определения частоты вращения 35 А и 35 Б как средства определения частоты вращения являются средствами определения частоты вращения двигателя N A и N B двигателей 3 A и 3 B и предусмотрены в двигателях 3 A и 3 B.
Датчик угла возвышения 196 3 Средство представляет собой средство для определения угла места a корпуса 2 . Угол возвышения указывает на наклон корпуса в воде относительно течения.
Датчик скорости корпуса 37 в качестве средства определения скорости корпуса является средством определения скорости корпуса V и представляет собой, например, электромагнитный лаг, доплеровский гидролокатор или GPS.
Датчики определения угла поперечного поворота 38 A и 38 B в качестве средств определения угла поперечного поворота являются средствами определения углов поперечного поворота θ A и θ B выносных устройств 10 A и 1 B. Датчики определения угла поперечного поворота 38 A и 38 B расположены рядом с гидравлическими приводами рулевого управления 17 A и 17 B и определяют углы поперечного поворота θ A и θ B устройств выносной передачи 10 A и 10 B на основе величин привода гидравлических приводов рулевого управления 17 A и 17 B. в качестве средства определения величины операции представляет собой датчик для определения величины операции на плоской рабочей поверхности и величины операции на рабочей поверхности кручения джойстика 21 . Датчик определения количества операций 39 определяет угол наклона и направление наклона джойстика 21 . Датчик определения величины срабатывания 39 определяет величину кручения джойстика 21 .
в качестве средства определения величины операции представляет собой датчик для определения величины операции на плоской рабочей поверхности и величины операции на рабочей поверхности кручения джойстика 21 . Датчик определения количества операций 39 определяет угол наклона и направление наклона джойстика 21 . Датчик определения величины срабатывания 39 определяет величину кручения джойстика 21 .
Датчики определения количества операций 43 A и 43 B в качестве средств определения количества операций представляют собой датчики для определения количества операций рычагов акселератора 22 A и 22 B. Датчики определения количества операций 43 A и 43 B определяют углы наклона рычагов акселератора. 22 A и 22 B. рабочего колеса 23 . Датчик 44 определения количества операций определяет величину вращения рабочего колеса 23 .
Датчик 44 определения количества операций определяет величину вращения рабочего колеса 23 .
Датчики определения скорости вращения выходного устройства 40 А и 40 Б как средства определения частоты вращения выводных устройств 10 А и 10 Б — датчики для определения частоты вращения винтовых движителей 15 А и 15 Б выносных устройств 10 A и 10 B, и расположены в средних частях выходного вала 14 A и 14 B. Датчики определения скорости вращения выходного устройства 40 A и 40 B определяют выходное устройство скорости вращения НД А и НД В .
Устройство управления 31 управляет приводами изменения скорости вращения 4 A и 4 B, муфтами переключения прямого/обратного хода 16 A и 16 B и гидроприводами рулевого управления
18 19 A 9 17 B, чтобы судно двигалось в направлении, заданном джойстиком 21 . Устройство управления 31 подключено соответственно к исполнительным механизмам изменения скорости вращения 4 А и 4 Б, муфты переключения переднего/заднего хода 16 А и 16 Б, гидроприводы рулевого управления 17 А и 17 Б, электромагнитные клапаны 18 и 18 А 92 Ba, джойстик 21 , рычаги акселератора 22 A и 22 B, рабочее колесо 23 , датчики определения скорости вращения 35 A и 35 B, датчик угла поворота,2818 36 , датчик скорости корпуса 37 , датчики определения угла поворота 38 A и 38 B , датчик определения количества операций 39 , датчики определения количества операций 43
Устройство управления 31 подключено соответственно к исполнительным механизмам изменения скорости вращения 4 А и 4 Б, муфты переключения переднего/заднего хода 16 А и 16 Б, гидроприводы рулевого управления 17 А и 17 Б, электромагнитные клапаны 18 и 18 А 92 Ba, джойстик 21 , рычаги акселератора 22 A и 22 B, рабочее колесо 23 , датчики определения скорости вращения 35 A и 35 B, датчик угла поворота,2818 36 , датчик скорости корпуса 37 , датчики определения угла поворота 38 A и 38 B , датчик определения количества операций 39 , датчики определения количества операций 43
8 92 A и 4 92 B, датчик 44 определения количества операций и датчики 40 A и 40 B определения скорости вращения выходного устройства. Устройство управления 31 включает в себя средство вычисления 32 , имеющий ЦП (центральный процессор) и средства хранения 33 , такие как ПЗУ, ОЗУ или жесткий диск.
Устройство управления 31 включает в себя средство вычисления 32 , имеющий ЦП (центральный процессор) и средства хранения 33 , такие как ПЗУ, ОЗУ или жесткий диск.
Далее будет дано пояснение способа расчета тяговых мощностей и направлений левого и правого передних приводов 10 A и 10 B с устройством управления 31 со ссылкой на фиг. 6.
Во-первых, определяется количество операций джойстика 21 (этап S 10 ), и на основе количества операций джойстика 21 , вектора движителя косого паруса Т Атранс и Т Бтранс для вектора движителя наклонного паруса и поворота Т Арот и Т Брот для поворота левого и правого выходных устройств 10 A и 10 B вычисляются соответственно (этап S 20 ).
Величина операции джойстика 21 угол наклона, направление наклона и величина кручения джойстика 21 и обнаружен датчиком определения количества операций 39 . Затем, на основе величин операций, устройство управления 31 вычисляет векторы мощности тяги наклонного парусного компонента T Atrans и T Btrans для векторов тяги наклонного парусного и поворотного компонентов T Arot и T Brot для поворота левого и правого выносных устройств 10 A и 10 B. Векторы сил наклонной составляющей парусности Т Aтранс и T Bтранс левого и правого передних приводов 10 A и 10 B рассчитываются, как показано на фиг. 7(А). Векторы тяги T Arot и T Brot левого и правого передних приводов 10 A и 10 B рассчитываются, как показано на фиг. 7(Б).
Затем, на основе величин операций, устройство управления 31 вычисляет векторы мощности тяги наклонного парусного компонента T Atrans и T Btrans для векторов тяги наклонного парусного и поворотного компонентов T Arot и T Brot для поворота левого и правого выносных устройств 10 A и 10 B. Векторы сил наклонной составляющей парусности Т Aтранс и T Bтранс левого и правого передних приводов 10 A и 10 B рассчитываются, как показано на фиг. 7(А). Векторы тяги T Arot и T Brot левого и правого передних приводов 10 A и 10 B рассчитываются, как показано на фиг. 7(Б).
Далее, векторы мощности тяги наклонного компонента парусности T Atrans и T Btrans и векторы мощности движителя поворотного компонента T Arot и T Brot левого и правого выносных устройств 10 A и 10 B составлены соответственно для расчета тяговых мощностей и направлений левого и правого выносных устройств 10 A и 10 В (этап S 30 ).
Как показано на РИС. 7(C), векторы T A и T B рассчитываются путем составления векторов мощности наклонной составляющей парусности T Atrans и T Btrans и вектора тяги поворотного элемента T Arot и T Brot левого и правого выносных приводов 10 A и 10 B, рассчитанные на шаге S 20 .
Далее на основе норм составных векторов Т А и Т В устройство управления 31 вычисляет скорость вращения N каждого из левого и правого двигателей 3 А и 3 В ( шаг S 40 ), муфты переключения переднего/заднего хода 16 A и 16 B переключаются, а левый и правый двигатели 3 A и 3 B являются приводными. На основе направлений составных векторов T A и T B вычисляются углы бокового поворота θ A и θ B выносных устройств 10 A и 10 B соответственно (этап S 50 ), а гидроприводы рулевого управления 17 A и 17 B приводятся в действие.
Далее будет дано объяснение процесса ограничения углов поперечного поворота пары левого и правого выходных устройств 10 А и 10 Б при расчете углов поворота θ А и θ B на шаге S 50 . Поскольку один и тот же процесс выполняется для пары левого и правого выходных устройств 10 A и 10 B, процесс ограничения угла поперечного поворота одного выходного устройства 10 A.
Когда угол (направление) β составных векторов T A превышает заданный диапазон углов выносного устройства 10 A на шаге S 50 в блок-схеме, выносное устройство 10 A управляется так, чтобы находиться в режиме заданного предельного угла.
Здесь заданный диапазон углов представляет собой диапазон, показанный косой чертой на фиг. 8, и представляет собой диапазон углов, в котором выходное устройство 10 А можно вращать. Поскольку гидропривод рулевого управления 17 A выполнен в виде гидроцилиндра и диапазон его вращения ограничен, обеспечивается заданный диапазон углов. Когда заданный диапазон углов обозначается как θ 1 , предельный угол обозначается как α, а задняя сторона рассматривается как 0°, соотношение между ними составляет -α<θ 1 ≤α. Поскольку вращение двигателя 3 A можно переключать между прямым и обратным вращением с помощью муфты переключения прямого/обратного хода 16 А, центрирование по лицевой стороне, т. е.) 180° (-180°), поперечный угол -180°<θ 1 ≦180°-(-α), 180°-α< θ 1 ≦180°. Например, когда α равно 30°, заданный диапазон углов составляет −180°<θ 1 ≤−150°, −30°<θ 1 ≤30°, 150°<θ 1 ≤180°.
Поскольку гидропривод рулевого управления 17 A выполнен в виде гидроцилиндра и диапазон его вращения ограничен, обеспечивается заданный диапазон углов. Когда заданный диапазон углов обозначается как θ 1 , предельный угол обозначается как α, а задняя сторона рассматривается как 0°, соотношение между ними составляет -α<θ 1 ≤α. Поскольку вращение двигателя 3 A можно переключать между прямым и обратным вращением с помощью муфты переключения прямого/обратного хода 16 А, центрирование по лицевой стороне, т. е.) 180° (-180°), поперечный угол -180°<θ 1 ≦180°-(-α), 180°-α< θ 1 ≦180°. Например, когда α равно 30°, заданный диапазон углов составляет −180°<θ 1 ≤−150°, −30°<θ 1 ≤30°, 150°<θ 1 ≤180°.
Далее будет дано пояснение по режиму ограничения угла.
В режиме ограничения угла для получения плавного хода после работы джойстиком 21 , движение осуществляется на пониженной мощности тяги. А именно, скорость вращения двигателя N A снижается до заданной скорости вращения N , установленной . В режиме предельного угла угол поворота θ A переднего привода 10 A фиксируется в состоянии заданного предельного угла. Конкретно, по углу (направлению) β векторов состава T A , определяемому с помощью устройства управления 31 , угол бокового поворота θ А выносного устройства 10 А определяется. Как показано на фиг. 9, в случае, когда ось X указывает угол β вектора состава T A , а ось Y указывает угол поперечного поворота θ A выносного устройства 10 A, когда угол β вектор состава T A находится в диапазоне −180°−(−α)<β≤−90°, угол бокового поворота θ A выносного устройства 10 A составляет −180°−(−α ). Когда угол β вектора композиции T A находится в диапазоне −90°<β≤−α, угол бокового поворота θ A выносного привода 10 A равен (−α).
А именно, скорость вращения двигателя N A снижается до заданной скорости вращения N , установленной . В режиме предельного угла угол поворота θ A переднего привода 10 A фиксируется в состоянии заданного предельного угла. Конкретно, по углу (направлению) β векторов состава T A , определяемому с помощью устройства управления 31 , угол бокового поворота θ А выносного устройства 10 А определяется. Как показано на фиг. 9, в случае, когда ось X указывает угол β вектора состава T A , а ось Y указывает угол поперечного поворота θ A выносного устройства 10 A, когда угол β вектор состава T A находится в диапазоне −180°−(−α)<β≤−90°, угол бокового поворота θ A выносного устройства 10 A составляет −180°−(−α ). Когда угол β вектора композиции T A находится в диапазоне −90°<β≤−α, угол бокового поворота θ A выносного привода 10 A равен (−α). Когда угол β составного вектора T A находится в пределах диапазона α<β≤90°, угол поперечного поворота θ A выходного устройства 10 A составляет α. Когда угол β вектора состава T A находится в диапазоне 90°<β≤180°−α, угол бокового поворота θ A выходного устройства 10 А составляет 180°-α.
Когда угол β составного вектора T A находится в пределах диапазона α<β≤90°, угол поперечного поворота θ A выходного устройства 10 A составляет α. Когда угол β вектора состава T A находится в диапазоне 90°<β≤180°−α, угол бокового поворота θ A выходного устройства 10 А составляет 180°-α.
Как показано на РИС. 9, в режиме предельного угла устанавливается допуск на люфт (гистерезис) для предотвращения частого изменения угла поворота θ A выносного устройства 10 A.
В случае, когда угол β вектор состава T A находится в диапазоне -180°-(-α)<β≤-90°, когда угол β вектора состава T A больше, чем -90°+γ, поворот угол θ A выносного устройства 10 А равно (-α). В случае, когда угол β вектора состава T A находится в диапазоне -90°<β≤-α, когда угол β вектора состава T A не превышает -90°- γ, угол поворота θ A выходного устройства 10 A составляет −180°−(−α).
В случае, когда угол β вектора состава T A находится в диапазоне α<β≤90°, когда угол β вектора состава T A больше 90°+γ угол поворота θ A выходного устройства 10 A составляет 180°-α. В случае, когда угол β вектора состава T A находится в диапазоне 90°<β≤180°-α, когда направление вектора состава T A составляет не более 90°-γ , угол поворота θ A выходного устройства 10 A равен α.
В режиме предельного угла скорость вращения двигателя N A двигателя 3 A может быть уменьшена в качестве альтернативы за счет уменьшения малого угла между направлением вектора состава T A и боковое направление корпуса 2 . Следуя уменьшению угла между направлением вектора состава T A и поперечным направлением корпуса (90° и −90°), то есть следуя сближению угла β вектора состава T A до 90° или −90° снижается частота вращения двигателя N А двигателя 3 А.
Как показано на ФИГ. 10 и 11, в режиме предельного угла за счет увеличения коэффициента снижения оборотов двигателя 3 А, частота вращения двигателя N А снижена.
Область, показанная косой чертой на РИС. 10 представляет собой область уменьшения скорости вращения, в которой скорость вращения двигателя N A снижается постепенно, а закрашенная область представляет собой область степени уменьшения 100%, в которой скорость уменьшения скорости вращения двигателя N A составляет 100%.
Конкретно, как показано на РИС. 11, в диапазоне более -180°-(-α) и не более Φ1 скорость восстановления увеличивается вслед за увеличением угла β вектора состава T А , а при Φ1 коэффициент снижения равен 100%, то есть частота вращения двигателя N А является низкой частотой вращения на холостом ходу.
Когда угол β вектора состава T A больше, чем Φ1, но не больше, чем Φ2, скорость восстановления поддерживается на уровне 100%.
Когда угол β вектора состава T A больше, чем Φ2, но не больше, чем -α, скорость восстановления снижается вслед за увеличением угла β. При −α скорость снижения равна 0 %, то есть частота вращения двигателя N A — скорость вращения двигателя, рассчитанная на шаге S 40 .
Здесь Φ1 и Φ2 представляют собой углы, линейно симметричные с -90°. Например, когда Φ1 равно -100°, Φ2 равно -80°.
Когда угол β вектора состава T A больше α, но не больше Φ3, скорость восстановления увеличивается вслед за увеличением угла β. При Φ3 степень снижения составляет 100%, то есть частота вращения двигателя N A является малой частотой вращения на холостом ходу.
Когда угол β вектора состава T A больше, чем Φ3, но не больше, чем Φ4, скорость восстановления поддерживается на уровне 100%.
Когда угол β вектора состава T A больше Φ4 и не превышает 180°−α, скорость восстановления уменьшается вслед за увеличением угла β. При 180°-α степень уменьшения составляет 0%, то есть скорость вращения двигателя N A представляет собой скорость вращения двигателя, вычисленную на этапе S 40 .
При 180°-α степень уменьшения составляет 0%, то есть скорость вращения двигателя N A представляет собой скорость вращения двигателя, вычисленную на этапе S 40 .
Здесь Φ3 и Φ4 — это углы, линейно симметричные с углом 90°. Например, когда Φ3 равно 80°, Φ4 равно 100°.
Φ1, Φ2, Φ3 и Φ4 могут быть изменены в пределах −180°−(−α)≤Φ1<−90°, −90°≤Φ2<−α, α≤Φ3<90° и 90° ≦Φ4<180°-α.
Как указано выше, судовое маневровое устройство 1 имеет пару левого и правого двигателей 3 А и 3 Б, приводы изменения скорости вращения 4 А и 4 Б, независимо изменяющие скорость вращения двигателей N пары левого и правого двигателей 3 A и 3 B, пара левого и правого передних приводов 10 A и 10 B соответственно, соединенных с парой левого и правого двигателей 3 A и 3 B и вращающих винт гребные винты 15 A и 15 B для приведения в движение корпуса 2 , муфты переключения вперед/назад 16 A и 16 B, расположенные между двигателями и B 3 9292 A и 3928 гребные винты 15 A и 15 B, пара левого и правого гидравлических рулевых приводов 17 A и 17 B, соответственно, независимо вращающих пару левого и правого выходных устройств 10 A и 10 B в поперечном направлении, джойстик 21 , устанавливающий направление движения корабля, датчик определения количества операций 39 , определяющий количество операций джойстика 21 , и устройство управления 31 , управляющее исполнительными механизмами изменения скорости вращения 4 A и 4 B, муфты переключения переднего/заднего хода 16 A и 16 B, а также гидравлические приводы рулевого управления 17 A и 17 B, чтобы двигаться в направлении, заданном джойстик 21 . По величине срабатывания джойстика 21 устройство управления 31 вычисляет векторы мощности тяги компонентов наклонного движения T Atrans и T Btrans для наклонного движения левого и правого выходных двигателей 10 А и 10 Б и вектора тяги поворотной составляющей Т Арот и Т Брот для поворота, и составляет векторы косой парусной тяги Т Атранс и Т Бтранс и поворотной вектора составной тяги T Arot и T Brot левого и правого приводных устройств 10 A и 10 B для расчета векторов состава T A и T B , таким образом рассчитывая тяговые мощности и направления левого и правого выходных устройств 10 A и 10 B.
По величине срабатывания джойстика 21 устройство управления 31 вычисляет векторы мощности тяги компонентов наклонного движения T Atrans и T Btrans для наклонного движения левого и правого выходных двигателей 10 А и 10 Б и вектора тяги поворотной составляющей Т Арот и Т Брот для поворота, и составляет векторы косой парусной тяги Т Атранс и Т Бтранс и поворотной вектора составной тяги T Arot и T Brot левого и правого приводных устройств 10 A и 10 B для расчета векторов состава T A и T B , таким образом рассчитывая тяговые мощности и направления левого и правого выходных устройств 10 A и 10 B.
Согласно конструкции, по сравнению со случаем расчета тяговых мощностей и направлений левое и правое выносные устройства 10 A и 10 B, основанные только на векторах тяговой силы наклонного парусного компонента T Atrans и T Btrans , с последующим расчетом тяговых мощностей и направлений левого и правого выносных устройств 10 A и 10 B на основе только векторов тяги поворотной составляющей T Arot и T Brot , путем расчета векторов состава T A и T B на основе тяги наклонной парусной составляющей векторов T Atrans и T Btrans и векторов тяговой силы поворотного компонента T Arot и T Brot можно рассчитать конечные тяговые мощности и конечные направления, благодаря чему достигается плавная работа без установки приоритета, а работоспособность улучшенный.
Когда угол β вектора состава T A (T B ) превышает заданный диапазон углов выносных устройств 10 A и 10 B, выносные устройства 10 A и B регулируются таким образом, чтобы переводить режим заданного предельного угла и скорость вращения двигателя N A (N B ) снижать до заданной скорости вращения N set .
Согласно построению, даже если угол β вектора композиции T A (T B ) выходит за заданный диапазон углов выносного устройства 10 A ( 10 B), рулевое управление выносных устройств 10 A ( 10 B) можно откорректировать.
Когда угол β вектора состава T A (T B ) превышает заданный диапазон углов выносного устройства 10 A ( 10 B), угол поворота θ A (θ B ) выносного устройства 10 А ( 10 Б) фиксируется в состоянии заданного предельного угла.
По конструкции при превышении угла вектора состава Т А (Т В ) над заданным диапазоном углов выносных устройств 10 А ( 10 В) частая смена поворота предотвращается угол и частое переключение прямого/обратного вращения выносного устройства 10 A ( 10 B).
Когда угол β вектора композиции T A (T B ) превышает заданный диапазон углов выносного устройства 10 A ( 10 B), частота вращения двигателя N A (N B ) двигателя 93 A ( 3 B ) уменьшается после уменьшения малого угла между направлением β вектора состава T A (T B ) и поперечным направлением корпуса.
Согласно построению, при угле β вектора композиции T А (Т Б ) Превышение заданного диапазона углов выносных устройств 10 А ( 10 Б), включение прямого/обратного вращения выносных устройств 10 А ( 10 Б) ) может выполняться плавно.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Настоящее изобретение может быть использовано для судна, имеющего стационарный мотор, в котором пара левого и правого двигателей расположена внутри корпуса, а мощность передается на пару левого и правого выходных устройств, расположенных снаружи корпус.
Организация и эволюция мобильных элементов вдоль хромосомы 3B мягкой пшеницы | Биология генома
- Исследования
- Открытый доступ
- Опубликовано:
- Жоскен Дарон 1,2 ,
- Наташа Гловер 1,2 ,
- Лиз Пинго 1,2 ,
- Себастьен Себастьен0400 1,2 ,
- Véronique Jamilloux 3 ,
- Etienne Paux 1,2 ,
- Valérie Barbe 4 ,
- Sophie Mangenot 4 ,
- Adriana Alberti 4 ,
- Patrick Wincker 4,5,6 ,
- Hadi Quesneville 3 ,
- Catherine Feuillet 1,2 &
- …
- Frédéric Choulet 1,2
Биология генома
том 15 , номер статьи: 546 (2014)
Процитировать эту статью
6772 Доступ
64 Цитаты
8 Альтметрический
Детали показателей
Abstract
Исходная информация
Геном мягкой пшеницы размером 17 Gb значительно расширился за счет распространения мобильных элементов (TE) и двух недавних раундов полиплоидизации. Сборка эталонной последовательности хромосомы 3B пшеницы размером 774 Мб предоставила нам возможность изучить влияние ТЕ на сложную структуру генома пшеницы и эволюцию с разрешением и масштабом, недостижимыми до сих пор.
Сборка эталонной последовательности хромосомы 3B пшеницы размером 774 Мб предоставила нам возможность изучить влияние ТЕ на сложную структуру генома пшеницы и эволюцию с разрешением и масштабом, недостижимыми до сих пор.
Результаты
Мы разрабатываем автоматизированный рабочий процесс CLARI-TE для моделирования ТЕ в сложных геномах. Мы точно очерчиваем 56 488 интактных и 196 391 фрагментированных TE вдоль псевдомолекулы 3B, что составляет 85% последовательности, и реконструируем 30 199 вложенных вставок. TE в основном молчали в течение последнего миллиона лет, а хромосома 3B была сформирована последовательностью всплесков, которые произошли между 1 и 3 миллионами лет назад. Ускоренная элиминация TE в дистальных регионах с высокой рекомбинацией является движущей силой разделения хромосом. CACTA, чрезмерно представленные в дистальных регионах с высокой рекомбинацией, в значительной степени связаны с недавно дуплицированными генами. Кроме того, мы идентифицируем 140 CACTA-опосредованных событий захвата генов с 17 генами, потенциально созданными путем перетасовки экзонов, и показываем, что 19захваченные гены транскрибируются и находятся под давлением отбора, что указывает на важную роль CACTA в недавней адаптации пшеницы.
Заключение
Точное моделирование TE раскрывает динамику TE в очень сложном полиплоидном геноме. Он дает новое представление о разделении хромосом и подчеркивает роль транспозонов CACTA в высоком уровне дупликации генов у пшеницы.
Исходная информация
Мобильные элементы (МЭ), впервые обнаруженные в кукурузе [1], являются повсеместными компонентами почти каждого исследованного до сих пор эукариотического генома, и их влияние на структуру и эволюцию генома в настоящее время хорошо известно (обзор в [2]). Были определены два класса TE: класс I, или ретротранспозоны, которые используют мРНК, кодируемую элементом, в качестве промежуточного продукта транспозиции; и транспозоны класса II, или ДНК-транспозоны, которые вырезаются из места их встраивания и транспонируются через промежуточное звено ДНК. Среди секвенированных геномов растений распространенность TE колеблется от 20% в Arabidopsis thaliana [3] до 85% в кукурузе ( Zea mays ) [4]. Расширение генома в основном опосредовано активностью элементов класса I, тогда как содержание ДНК-транспозонов гораздо более постоянно [5]-[7]. Кроме того, TE неслучайно распределены по геному из-за вставок [8], [9] и делеций [7], [10], которые запускают расширение/сжатие генома. Таким образом, у риса ( Oryza sativa ) [11], сорго ( Sorghum bicolor ) [12] и кукурузы ретротранспозоны с длинными концевыми повторами (LTR-RT) преимущественно накапливаются в гетерохроматине, например, в центромерных областях, и менее распространены. в рекомбиногенных дистальных частях хромосом. Молекулярный механизм, ответственный за целенаправленную интеграцию TEs в гетерохроматин, начал пониматься [13]. Ключевым компонентом интеграционного комплекса ТЕ является хромодомен, присутствующий в карбоксиконцевой части кодируемой элементом интегразы в некоторых gypsy элементов [14], которые управляют предпочтительной вставкой путем нацеливания на специфические модификации хроматина [15]. Делецию TE можно идентифицировать по идентификации одиночных LTR и укороченных элементов [6].
Расширение генома в основном опосредовано активностью элементов класса I, тогда как содержание ДНК-транспозонов гораздо более постоянно [5]-[7]. Кроме того, TE неслучайно распределены по геному из-за вставок [8], [9] и делеций [7], [10], которые запускают расширение/сжатие генома. Таким образом, у риса ( Oryza sativa ) [11], сорго ( Sorghum bicolor ) [12] и кукурузы ретротранспозоны с длинными концевыми повторами (LTR-RT) преимущественно накапливаются в гетерохроматине, например, в центромерных областях, и менее распространены. в рекомбиногенных дистальных частях хромосом. Молекулярный механизм, ответственный за целенаправленную интеграцию TEs в гетерохроматин, начал пониматься [13]. Ключевым компонентом интеграционного комплекса ТЕ является хромодомен, присутствующий в карбоксиконцевой части кодируемой элементом интегразы в некоторых gypsy элементов [14], которые управляют предпочтительной вставкой путем нацеливания на специфические модификации хроматина [15]. Делецию TE можно идентифицировать по идентификации одиночных LTR и укороченных элементов [6]. Предположительно, соло LTR образуются в результате неравной внутрихромосомной гомологичной рекомбинации между двумя LTR интактного элемента [16]. Напротив, считается, что укороченные элементы являются результатом нелегитимной (негомологичной) рекомбинации. У риса 190 Мб ДНК LTR-RT были недавно удалены этими двумя процессами, в результате чего остался текущий геном размером приблизительно 400 Мб, который содержит <100 Мб обнаруживаемых LTR-RT [17]. У сорго и риса ДНК-транспозоны локализованы в основном в теломерных областях хромосомы [11], [12]. Однако доказательств прямой зависимости между скоростью генетической рекомбинации и обилием ДНК-транспозонов в геномах растений до сих пор не получено [18], тогда как она наблюдалась в Caenorhabditis elegans [19]. Ключевым аспектом транспозонов ДНК является их взаимодействие с генами хозяина [20]. Например, было показано, что они участвуют в создании новых генов посредством «перетасовки экзонов». У кукурузы 60% из 20 000 Helitron содержат захваченные фрагменты генов [21], [22].
Предположительно, соло LTR образуются в результате неравной внутрихромосомной гомологичной рекомбинации между двумя LTR интактного элемента [16]. Напротив, считается, что укороченные элементы являются результатом нелегитимной (негомологичной) рекомбинации. У риса 190 Мб ДНК LTR-RT были недавно удалены этими двумя процессами, в результате чего остался текущий геном размером приблизительно 400 Мб, который содержит <100 Мб обнаруживаемых LTR-RT [17]. У сорго и риса ДНК-транспозоны локализованы в основном в теломерных областях хромосомы [11], [12]. Однако доказательств прямой зависимости между скоростью генетической рекомбинации и обилием ДНК-транспозонов в геномах растений до сих пор не получено [18], тогда как она наблюдалась в Caenorhabditis elegans [19]. Ключевым аспектом транспозонов ДНК является их взаимодействие с генами хозяина [20]. Например, было показано, что они участвуют в создании новых генов посредством «перетасовки экзонов». У кукурузы 60% из 20 000 Helitron содержат захваченные фрагменты генов [21], [22]. Точно так же у риса было идентифицировано 2809 Pack-Mutator-подобных элементов (Pack-MULE), содержащих фрагменты генов-хозяев [23].
Точно так же у риса было идентифицировано 2809 Pack-Mutator-подобных элементов (Pack-MULE), содержащих фрагменты генов-хозяев [23].
Идентификация мобильных элементов в больших и сложных геномах является сложной задачей даже в высококачественных собранных геномах. Например, с 2001 года в геноме риса количество обнаруженных миниатюрных ТЕ с инвертированными повторами (MITE) неуклонно увеличивалось с 6641 до 179.,415 [24]-[28]. Высококачественное предсказание и аннотация TE необходимы для предотвращения неправильной аннотации функциональных генов и понимания биологии геномов [29]. Были разработаны различные стратегии, включая поиск сходства в банках данных известных последовательностей TE, обнаружение повторов de novo , подсчет на основе k-mer и обнаружение структурных мотивов (обзор в [30]). Несмотря на разработку множества специализированных биоинформационных инструментов, точное моделирование ТЕ в сложных (> 1 Гб) геномах, таких как пшеница или кукуруза, представляет собой сложную задачу. 3412 проявление силы . В ходе проекта секвенирования генома кукурузы (примерно 2 Гб) TE были предсказаны с помощью различных подходов: LTR-RT и Helitrons были идентифицированы по структурным критериям, а остальные TE были аннотированы по сходству с библиотекой, созданной de novo. обнаружение [4]. Одним из основных ограничений для идентификации TE, и особенно больших TE (> 5 КБ), была фрагментация сборки с большим количеством пробелов и коротким медианным размером контига (примерно 7 КБ).
3412 проявление силы . В ходе проекта секвенирования генома кукурузы (примерно 2 Гб) TE были предсказаны с помощью различных подходов: LTR-RT и Helitrons были идентифицированы по структурным критериям, а остальные TE были аннотированы по сходству с библиотекой, созданной de novo. обнаружение [4]. Одним из основных ограничений для идентификации TE, и особенно больших TE (> 5 КБ), была фрагментация сборки с большим количеством пробелов и коротким медианным размером контига (примерно 7 КБ).
Геном пшеницы большой и очень сложный (17 ГБ, аллогексаплоид 2n = 6x = 42 с 3 близкородственными субгеномами, AABBDD). Предыдущие мелкомасштабные анализы показали, что геном пшеницы состоит примерно из 80% последовательностей, происходящих от TE, в основном вложенных друг в друга, и с несколькими семействами, представляющими 50% фракции TE [31]. Раннее ручное моделирование ТЕ выполнялось на выбранных последовательностях бактериальных искусственных хромосом (ВАС) во время проектов клонирования на основе карт или с использованием концевых последовательностей плазмид или ВАС [32]-[36]. В более крупном масштабе анализ длинных последовательностей контигов BAC длиной 18 Мб, распределенных вдоль хромосомы 3B [31], привел к точному определению 3222 TE. Вместе с публикой Triticeae База данных последовательностей REPeat (TREP) [37], это обеспечило репрезентативную высококачественную справочную библиотеку ТЕ пшеницы. Помимо идентификации TE, реконструкция вложенного шаблона вставки представляет собой вычислительную задачу, требующую точной настройки специальных алгоритмов и знания структуры и эволюции TE.
В более крупном масштабе анализ длинных последовательностей контигов BAC длиной 18 Мб, распределенных вдоль хромосомы 3B [31], привел к точному определению 3222 TE. Вместе с публикой Triticeae База данных последовательностей REPeat (TREP) [37], это обеспечило репрезентативную высококачественную справочную библиотеку ТЕ пшеницы. Помимо идентификации TE, реконструкция вложенного шаблона вставки представляет собой вычислительную задачу, требующую точной настройки специальных алгоритмов и знания структуры и эволюции TE.
Недавно из различных геномов пшеницы был получен ряд последовательностей в масштабе генома. Секвенирование полного генома с использованием технологий короткого считывания было выполнено на мягкой пшенице и диплоидных видах, связанных с гомеологичными геномами A и D [38]-[40]. Хотя эти последовательности были полезны для характеристики генного пространства, сборки были сильно фрагментированы и, следовательно, имели лишь ограниченную ценность для изучения TE. Более того, они не обеспечивают достаточную смежность последовательностей для сборки псевдомолекул, препятствуя анализу любого распределения признаков TE вдоль хромосомы. Для получения эталонной последовательности генома мягкой пшеницы Международный консорциум по секвенированию генома пшеницы (IWGSC) [41] разработал подход, основанный на потоковой сортировке отдельных хромосом и построении и секвенировании физических карт, специфичных для хромосом. Недавно мы получили псевдомолекулу для самой большой хромосомы пшеницы (3B), которая представляет собой 774 Мб, несет 7264 гена и 85% последовательностей, полученных из TE [42]. Генная аннотация и сравнительный анализ показали, что хромосома 3В и геном пшеницы в целом [43] несет большее количество генов, чем родственные виды злаков. Более того, результаты показали, что около 35% генов 3B имеют сходство с генами, расположенными на неортологичных хромосомах у других злаков [42]. Эти «несинтетические» гены, вероятно, происходят из межхромосомных дупликаций, запускаемых различными механизмами, такими как репарация двухцепочечных разрывов или мобилизация TE.
Более того, они не обеспечивают достаточную смежность последовательностей для сборки псевдомолекул, препятствуя анализу любого распределения признаков TE вдоль хромосомы. Для получения эталонной последовательности генома мягкой пшеницы Международный консорциум по секвенированию генома пшеницы (IWGSC) [41] разработал подход, основанный на потоковой сортировке отдельных хромосом и построении и секвенировании физических карт, специфичных для хромосом. Недавно мы получили псевдомолекулу для самой большой хромосомы пшеницы (3B), которая представляет собой 774 Мб, несет 7264 гена и 85% последовательностей, полученных из TE [42]. Генная аннотация и сравнительный анализ показали, что хромосома 3В и геном пшеницы в целом [43] несет большее количество генов, чем родственные виды злаков. Более того, результаты показали, что около 35% генов 3B имеют сходство с генами, расположенными на неортологичных хромосомах у других злаков [42]. Эти «несинтетические» гены, вероятно, происходят из межхромосомных дупликаций, запускаемых различными механизмами, такими как репарация двухцепочечных разрывов или мобилизация TE.
В этом исследовании была разработана стратегия, посвященная моделированию ТЕ в сложном геноме, чтобы расшифровать сложную организацию ТЕ вдоль хромосомы пшеницы. Анализ распределения обилия, разнообразия и динамики TE выявил поразительное разделение хромосомы, наблюдаемое для других признаков на хромосоме 3B [42]. Кроме того, мы наблюдали массовую амплификацию транспозонов ДНК CACTA по сравнению с другими родственными видами трав со значительной связью между некоторыми семействами CACTA и недавно продублированными генами, что указывает на роль транспозонов CACTA в дупликации генов, захвате генов и пластичности генома у пшеницы.
Результаты
Усовершенствованная процедура прогнозирования моделей мобильных элементов и их вложенных паттернов в сложном геноме
Прогнозирование признаков TE в сложных геномах, где повторяющиеся элементы представляют более 80% последовательности, остается вычислительной проблемой, и получение высокого качества аннотация по-прежнему требует ручной обработки. Как правило, предсказание ТЕ выполняется путем поиска сходства с набором известных последовательностей ТЕ. Основным условием для достижения высокого качества аннотаций является наличие курируемой справочной библиотеки TE. Это важно для идентификации большинства транспозонов с помощью подходов, основанных на поиске подобия, и для ограничения de novo обнаружение повторов в неназначенной части последовательности генома. По пшенице доступны две кураторские библиотеки, посвященные ТЕ Triticeae (пшеница, ячмень и рожь): TREP, который содержит 1717 ТЕ, представляющих 323 семейства, и дополнительный набор из 3212 ТЕ, аннотированных вручную в предыдущем пилотном исследовании хромосомы 3B. 31]. Для большинства из них границы мобильного элемента точно определены, а также доступна их полнота, то есть «полный элемент» против «фрагментированного элемента». Однако в классификации ТЕ есть несоответствия; большинству TE было присвоено имя семейства на основе их лучшего попадания BLAST, что может привести к завышению количества семейств [44].
Как правило, предсказание ТЕ выполняется путем поиска сходства с набором известных последовательностей ТЕ. Основным условием для достижения высокого качества аннотаций является наличие курируемой справочной библиотеки TE. Это важно для идентификации большинства транспозонов с помощью подходов, основанных на поиске подобия, и для ограничения de novo обнаружение повторов в неназначенной части последовательности генома. По пшенице доступны две кураторские библиотеки, посвященные ТЕ Triticeae (пшеница, ячмень и рожь): TREP, который содержит 1717 ТЕ, представляющих 323 семейства, и дополнительный набор из 3212 ТЕ, аннотированных вручную в предыдущем пилотном исследовании хромосомы 3B. 31]. Для большинства из них границы мобильного элемента точно определены, а также доступна их полнота, то есть «полный элемент» против «фрагментированного элемента». Однако в классификации ТЕ есть несоответствия; большинству TE было присвоено имя семейства на основе их лучшего попадания BLAST, что может привести к завышению количества семейств [44].
Чтобы обеспечить правильное моделирование ТЕ 774 Мб последовательности из хромосомы 3B, мы сначала создали классифицированную библиотеку ТЕ (ClariTeRep; см. Материалы и методы), используя 3050 полных последовательностей ТЕ из этих двух библиотек. Всего было кластеризовано 525 семейств, содержащих от 1 до 266 копий каждое, на основе сходства их последовательностей. Среди семей, описанных в TREP, 40% (277/700) имеют однозначную связь с классификацией ClariTeRep, в то время как остальные были в основном объединены в одну семью, а иногда и разделены на разные семьи. Более 80% семейств TREP содержат только одну-две копии TE по сравнению с 57% для ClariTeRep, что подтверждает, что классификация на основе сходства увеличивает количество семейств по сравнению с подходом на основе кластеризации [44].
На втором этапе мы автоматизировали две вещи: (i) исправление сверхфрагментации прогнозов ТЕ, то есть того факта, что ТЕ определяется не как единый признак, а разделяется на несколько соседних; и (ii) реконструкция вложенных вставок TE. С этой целью мы разработали программу под названием CLARI-TE, которая позволяет объединять соседние прогнозы, принадлежащие к одному семейству (см. Материалы и методы). Затем автоматически реконструировались вложенные кластеры путем объединения удаленных прогнозов, принадлежащих одному элементу. Мы оценили точность автоматической аннотации, проанализировав аннотированную вручную последовательность размером примерно 1 МБ (скаффолд v443_0137), содержащую 196 TE и 47 вложенных вставок, которые были вручную аннотированы для этой цели. Мы сравнили аннотацию, созданную RepeatMasker (с использованием ClariTeRep), с аннотацией из CLARI-TE и другого конвейера аннотаций, TEannot (часть пакета REPET [45]) (таблица 1). На уровне нуклеотидов RepeatMasker правильно определил примерно 90% нуклеотидов, принадлежащих ТЕ, что показывает, что наша библиотека ТЕ достаточно полна, чтобы обнаружить подавляющее большинство ТЕ в геномной последовательности пшеницы. Однако 196 ТЕ были предсказаны как 59.0 отдельные функции с помощью RepeatMasker, иллюстрирующие проблему чрезмерной фрагментации.
С этой целью мы разработали программу под названием CLARI-TE, которая позволяет объединять соседние прогнозы, принадлежащие к одному семейству (см. Материалы и методы). Затем автоматически реконструировались вложенные кластеры путем объединения удаленных прогнозов, принадлежащих одному элементу. Мы оценили точность автоматической аннотации, проанализировав аннотированную вручную последовательность размером примерно 1 МБ (скаффолд v443_0137), содержащую 196 TE и 47 вложенных вставок, которые были вручную аннотированы для этой цели. Мы сравнили аннотацию, созданную RepeatMasker (с использованием ClariTeRep), с аннотацией из CLARI-TE и другого конвейера аннотаций, TEannot (часть пакета REPET [45]) (таблица 1). На уровне нуклеотидов RepeatMasker правильно определил примерно 90% нуклеотидов, принадлежащих ТЕ, что показывает, что наша библиотека ТЕ достаточно полна, чтобы обнаружить подавляющее большинство ТЕ в геномной последовательности пшеницы. Однако 196 ТЕ были предсказаны как 59.0 отдельные функции с помощью RepeatMasker, иллюстрирующие проблему чрезмерной фрагментации. Улучшение было значительным при использовании как TEannot, так и CLARI-TE, которые обнаружили 345 и 286 признаков соответственно (таблица 1). CLARI-TE был более точным, чем TEannot, в предсказании правильных границ TE (чувствительность 66% против 45% соответственно) и в ограничении количества ложноположительных результатов (специфичность 52% против 27% соответственно). Кроме того, CLARI-TE смог выполнить реконструкцию вложенных кластеров гораздо точнее, чем TEannot (таблица 1). Точность интеллектуального анализа с вложенными вставками на самом деле сильно зависела от типа TE: чувствительность и специфичность были намного выше для gypsy и copy элементов (53% и 68% соответственно), чем у CACTA (13% и 40% соответственно). Это говорит о том, что CACTA демонстрируют более высокий уровень изменчивости последовательностей и что типичные для CACTA короткие тандемные повторы ограничивают нашу способность идентифицировать их с помощью полностью автоматизированных процедур.
Улучшение было значительным при использовании как TEannot, так и CLARI-TE, которые обнаружили 345 и 286 признаков соответственно (таблица 1). CLARI-TE был более точным, чем TEannot, в предсказании правильных границ TE (чувствительность 66% против 45% соответственно) и в ограничении количества ложноположительных результатов (специфичность 52% против 27% соответственно). Кроме того, CLARI-TE смог выполнить реконструкцию вложенных кластеров гораздо точнее, чем TEannot (таблица 1). Точность интеллектуального анализа с вложенными вставками на самом деле сильно зависела от типа TE: чувствительность и специфичность были намного выше для gypsy и copy элементов (53% и 68% соответственно), чем у CACTA (13% и 40% соответственно). Это говорит о том, что CACTA демонстрируют более высокий уровень изменчивости последовательностей и что типичные для CACTA короткие тандемные повторы ограничивают нашу способность идентифицировать их с помощью полностью автоматизированных процедур.
Таблица 1
Сравнение точности моделирования мобильных элементов на каркасе размером 1 Мб из хромосомы пшеницы 3B
Полная таблица
Содержание и распределение мобильных элементов вдоль хромосомы 3B
Мы использовали CLARI-TE для прогнозирования моделей TE вдоль 833 Mb хромосомы 3B (последовательность, соответствующая псевдомолекуле 3B (774 Mb) и незаякоренным каркасам (59 Mb)) для изучения организации и динамики ТЕ вдоль хромосомы пшеницы. В общей сложности 523 233 обнаруженных RepeatMasker признаков были объединены с CLARI-TE, чтобы получить окончательный набор из 56 488 полных TE (то есть с двумя границами, соответствующими границам опорного элемента) и 196391 усеченный или частично собранный элемент. Учитывая оценки чувствительности и специфичности нашего подхода к прогнозированию полных TE, мы можем экстраполировать примерно до 73 000 количество интактных TE, переносимых хромосомой 3B. Таким образом, с помощью CLARI-TE мы можем вдвое уменьшить фрагментацию аннотации и обнаружить самый большой набор полноразмерных ТЕ и вложенных кластеров, когда-либо наблюдавшихся на хромосоме растений. Количество крупных ТЕ (>5 кб) увеличилось вдвое (с 16,9от 88 до 30 894) при использовании CLARI-TE. Кроме того, было реконструировано 30 199 вложенных вставок, включающих до 8 слоев и 320 кластеров размером более 100 кб (и до 301 кб). В целом, TE составляют 85% от 833 Mb каркасов хромосомы 3B. Кроме того, при идентификации de novo было выявлено 3% ранее не охарактеризованных МЭ [42].
В общей сложности 523 233 обнаруженных RepeatMasker признаков были объединены с CLARI-TE, чтобы получить окончательный набор из 56 488 полных TE (то есть с двумя границами, соответствующими границам опорного элемента) и 196391 усеченный или частично собранный элемент. Учитывая оценки чувствительности и специфичности нашего подхода к прогнозированию полных TE, мы можем экстраполировать примерно до 73 000 количество интактных TE, переносимых хромосомой 3B. Таким образом, с помощью CLARI-TE мы можем вдвое уменьшить фрагментацию аннотации и обнаружить самый большой набор полноразмерных ТЕ и вложенных кластеров, когда-либо наблюдавшихся на хромосоме растений. Количество крупных ТЕ (>5 кб) увеличилось вдвое (с 16,9от 88 до 30 894) при использовании CLARI-TE. Кроме того, было реконструировано 30 199 вложенных вставок, включающих до 8 слоев и 320 кластеров размером более 100 кб (и до 301 кб). В целом, TE составляют 85% от 833 Mb каркасов хромосомы 3B. Кроме того, при идентификации de novo было выявлено 3% ранее не охарактеризованных МЭ [42]. Мы применили тот же подход для аннотирования черновых последовательностей геномов A- и D-родственных диплоидных предшественников: Triticum urartu (примерно 3 Гб) [39] и Aegilops tauschii (примерно 2,6 Гб) [40]. TE составляют 77% и 74% диплоидных геномных сборок A и D соответственно (таблица S1 в дополнительном файле 1). Мы также обнаружили, что доля полных МЭ составляет 12% и 11% соответственно, то есть в два раза меньше, чем на хромосоме 3В (22%).
Мы применили тот же подход для аннотирования черновых последовательностей геномов A- и D-родственных диплоидных предшественников: Triticum urartu (примерно 3 Гб) [39] и Aegilops tauschii (примерно 2,6 Гб) [40]. TE составляют 77% и 74% диплоидных геномных сборок A и D соответственно (таблица S1 в дополнительном файле 1). Мы также обнаружили, что доля полных МЭ составляет 12% и 11% соответственно, то есть в два раза меньше, чем на хромосоме 3В (22%).
В аннотации показано, что ТЕ класса I и II составляют 67 % и 18 % последовательности 3B соответственно, при этом подавляющее большинство хромосом соответствует LTR-RT (529 Mb, 66 % хромосомы; таблица S1 в Дополнительном файл 1). Три суперсемейства ( цыган , 47%; КАКТА, 16%; копия , 16%) составляют более 79% от общей фракции ТЭ (рис. 1А). Эта доля CACTA намного выше, чем у других секвенированных злаков: 3,2 % у кукурузы [4], 4,7 % у сорго [12], 3,4 % у риса [11] и 2,2 % у Brachypodium distachyon [46]. Мы также обнаружили более высокую долю CACTA в черновых последовательностях генома T. urartu и Ae. tauschii (12,3% и 15,6% соответственно; таблица S1 в дополнительном файле 1), предполагая, что большая часть амплификации CACTA произошла до расхождения геномов A, B и D. Другие транспозоны ДНК менее распространены с точки зрения пропорций, но некоторые из них соответствуют элементам небольшого размера, обнаруженным в очень большом количестве копий. Например, 17 479Вдоль последовательности хромосом 3B были обнаружены MITE (сгруппированные в 95 семейств) размером в среднем 142 п.н., в основном из суперсемейства Mariner .
Мы также обнаружили более высокую долю CACTA в черновых последовательностях генома T. urartu и Ae. tauschii (12,3% и 15,6% соответственно; таблица S1 в дополнительном файле 1), предполагая, что большая часть амплификации CACTA произошла до расхождения геномов A, B и D. Другие транспозоны ДНК менее распространены с точки зрения пропорций, но некоторые из них соответствуют элементам небольшого размера, обнаруженным в очень большом количестве копий. Например, 17 479Вдоль последовательности хромосом 3B были обнаружены MITE (сгруппированные в 95 семейств) размером в среднем 142 п.н., в основном из суперсемейства Mariner .
Рисунок 1
Содержание мобильных элементов и число копий последовательности 3B хромосомы пшеницы. (A) Круговая диаграмма относительного состава основных суперсемейств TE. (B) Кумулятивная сумма числа семейств TE среди фракции TE. N50 равно 6, что означает, что шесть семейств ТЕ представляют 50% фракции ТЕ (по количеству нуклеотидов). (C) Распределение количества экземпляров на семью (с учетом только полных экземпляров). (D) Коробчатая диаграмма расстояния (в килобазах) TE до ближайшего гена. Пять категорий представляют семьи TE с разным количеством копий на хромосоме 3B.
(C) Распределение количества экземпляров на семью (с учетом только полных экземпляров). (D) Коробчатая диаграмма расстояния (в килобазах) TE до ближайшего гена. Пять категорий представляют семьи TE с разным количеством копий на хромосоме 3B.
Полноразмерное изображение
Всего вдоль хромосомы 3B было обнаружено 485 семей, из которых только 6 семей представляли 50 % фракции TE, а 143 — 99 % фракции TE (рис. 1B). Наиболее распространенным элементом было семейство LTR-RT RLG_famc1 (Fatima) с 7036 полными и 8003 фрагментированными копиями, которые сами по себе составляют 12% фракции TE. Пятнадцать процентов (74) семей представлены одним копийным элементом на всей последовательности хромосомы 3B, в то время как 2% (7) амплифицированы до более чем 1000 копий. Следовательно, большинство семейств TE не являются членами семейств с одной копией, а скорее амплифицируются со средним числом копий (от 11 до 100) в этой хромосоме (рис. 1C). Эта закономерность отличается от того, что было описано для родственных злаков, где семейства с одной копией представляют от 66% до 81% семейств риса, Brachypodium , сорго и кукуруза [44]. Мы оценили влияние методов классификации на эти результаты, сравнив средний процент идентичности между членами семейств LTR-RT для разных геномов травы (рисунок S1 в дополнительном файле 1). Наш подход к кластеризации привел в среднем к 77% идентичности по всей длине TE, в то время как этот процент был выше (от 86% до 89%) в классификации El Baidouri et al . [44] для Brachypodium , рис, сорго и кукуруза. Применение отсечки при идентичности 77% показало, что доля членов семейства с одной копией резко снижается у родственных злаков (16%, 52%, 25% и 17% у риса, Brachypodium , сорго и кукурузы соответственно), что приводит к к распределению, аналогичному тому, которое наблюдается у пшеницы. При расчете расстояния между каждым TE и соседними генами мы заметили, что семьи с низким числом копий значительно ближе к генам, чем семьи с высокой повторяемостью (односторонний ANOVA, P -значения <4.5e -11 ; Рисунок 1D). Действительно, семьи с менее чем 100 копиями оказались значительно ближе к генам, чем семьи, имеющие более 100 копий (критерий Боннферрони/Данна, P — значения <4e -4 ).
Мы оценили влияние методов классификации на эти результаты, сравнив средний процент идентичности между членами семейств LTR-RT для разных геномов травы (рисунок S1 в дополнительном файле 1). Наш подход к кластеризации привел в среднем к 77% идентичности по всей длине TE, в то время как этот процент был выше (от 86% до 89%) в классификации El Baidouri et al . [44] для Brachypodium , рис, сорго и кукуруза. Применение отсечки при идентичности 77% показало, что доля членов семейства с одной копией резко снижается у родственных злаков (16%, 52%, 25% и 17% у риса, Brachypodium , сорго и кукурузы соответственно), что приводит к к распределению, аналогичному тому, которое наблюдается у пшеницы. При расчете расстояния между каждым TE и соседними генами мы заметили, что семьи с низким числом копий значительно ближе к генам, чем семьи с высокой повторяемостью (односторонний ANOVA, P -значения <4.5e -11 ; Рисунок 1D). Действительно, семьи с менее чем 100 копиями оказались значительно ближе к генам, чем семьи, имеющие более 100 копий (критерий Боннферрони/Данна, P — значения <4e -4 ).
В целом распределение ТЕ вдоль хромосомы сильно коррелирует с распределением gypsy элементов (R = 0,97) и отрицательно коррелирует со скоростью рекомбинации (R = -0,82, P -значения <10e -10 ) (таблица S2 в дополнительном файле 1). Надсемейство CACTA демонстрирует прямо противоположную картину со значительным увеличением на 23% в дистальных отделах (от 18 до 19%) по сравнению с проксимальными отделами (15%; рисунок 2). Подобно CACTA, но на более низком уровне, транспозоны класса II — Harbingers, hATs, Mariners, Mutators и Helitrons — в два раза преобладают в дистальных областях по сравнению с проксимальными областями, и их распределение сильно коррелирует как с плотностью генов ( R = 0,63) и скорость рекомбинации (R = 0,71).
Рисунок 2
Распределение вариаций плотности мобильных элементов вдоль хромосомы 3B пшеницы. Распределения представлены для четырех надсемейств: gypsy (синие), copya (зеленые), CACTA (красные) и другие транспозоны ДНК (фиолетовые). Распределения были рассчитаны в скользящем окне размером 10 МБ с шагом 1 МБ, а графики представляют стандартную оценку, то есть отклонения от среднего значения числа стандартных отклонений. Рекомбиногенные дистальные и центромерные/прицентромерные области [42] отмечены серыми и заштрихованными областями соответственно.
Распределения были рассчитаны в скользящем окне размером 10 МБ с шагом 1 МБ, а графики представляют стандартную оценку, то есть отклонения от среднего значения числа стандартных отклонений. Рекомбиногенные дистальные и центромерные/прицентромерные области [42] отмечены серыми и заштрихованными областями соответственно.
Изображение полного размера
Также было исследовано распределение разнообразия TE, т. е. количества различных семейств на 10 Мб, вдоль хромосомы. Выявлено более высокое разнообразие в дистальных областях (в среднем 210 различных семейств TE на 10 Мб, максимум 244 семейства в пределах 10 Мб), чем в центральной части хромосомы (134 различных семейства на 10 Мб; рисунок S3 в дополнительном файле 1). ). Разнообразие ДНК-транспозонов увеличивается в 2,6 раза в дистальной области по сравнению с центромерой, тогда как разнообразие LTR-RT однородно вдоль хромосомы (106 ± 7 семей на 10 Мб; рисунок S3 в дополнительном файле 1). Стоит отметить, что закономерности распределения разнообразия МЭ и плотности МЭ противоположны. Таким образом, увеличение количества МЭ в центромерных районах происходит за счет накопления нескольких копий из одних и тех же семейств.
Таким образом, увеличение количества МЭ в центромерных районах происходит за счет накопления нескольких копий из одних и тех же семейств.
Сегментационный анализ (см. Материалы и методы) вариаций плотности МЭ вдоль хромосомы показал наличие пяти различных областей. Два конца хромосомы, составляющие 18% хромосомы (63 Мпн и 73 Мб на коротком и длинном плече соответственно), демонстрируют самое низкое содержание ТЕ (71%). 122 Mb (16 % участка хромосомы), охватывающих центромеру [42], имеют самое высокое содержание TE (93%). Наконец, в двух основных частях плеч хромосом (66% хромосомы; 200 Мпн и 316 Мб для короткого и длинного плеч соответственно) среднее содержание ТЕ составляет 88%. Границы двух дистальных TE-бедных областей почти точно соответствуют областям (R1 и R3), определенным паттерном рекомбинации в [42].
Неравномерное распределение и влияние мобильных элементов на эволюцию структуры хромосомы
Чтобы исследовать эволюционную динамику LTR-RT в хромосоме 3B, мы оценили даты вставки 21 165 интактных копий. Мы проанализировали распределение дат вставки отдельных копий для каждого из 43 семейств, содержащих не менее 20 копий, чтобы определить дату всплеска и период активности для конкретного семейства (рис. 3A). Наш анализ показал, что 93% всплесков TE произошли между 1 и 3 миллионами лет назад (млн лет назад; рис. 3B), подтверждая на всем хромосомном масштабе, что амплификация TE замедлилась и/или делеция TE увеличилась за последний 1 миллион лет. лет [31]. Активные периоды транспозиции (рис. 3B) длились от 1 до 3 миллионов лет и соответствуют последовательности всплесков в среднем каждые 40 000 лет. Это указывает на то, что геном пшеницы был сформирован последовательными волнами активации TE, за которыми быстро последовало замалчивание. Действительно, 69По оценкам, % семей были активны в течение периодов от 1,5 до 2,5 миллионов лет. Только несколько семей были активны в течение более длительного периода времени, что позволяет предположить, что они избежали молчания. Неудивительно, что интенсивность всплеска отрицательно коррелировала с периодом амплификации (R = -0,4, P — значения = 0,007), предполагая, что чем выше уровень активности, тем быстрее устанавливалось молчание.
Мы проанализировали распределение дат вставки отдельных копий для каждого из 43 семейств, содержащих не менее 20 копий, чтобы определить дату всплеска и период активности для конкретного семейства (рис. 3A). Наш анализ показал, что 93% всплесков TE произошли между 1 и 3 миллионами лет назад (млн лет назад; рис. 3B), подтверждая на всем хромосомном масштабе, что амплификация TE замедлилась и/или делеция TE увеличилась за последний 1 миллион лет. лет [31]. Активные периоды транспозиции (рис. 3B) длились от 1 до 3 миллионов лет и соответствуют последовательности всплесков в среднем каждые 40 000 лет. Это указывает на то, что геном пшеницы был сформирован последовательными волнами активации TE, за которыми быстро последовало замалчивание. Действительно, 69По оценкам, % семей были активны в течение периодов от 1,5 до 2,5 миллионов лет. Только несколько семей были активны в течение более длительного периода времени, что позволяет предположить, что они избежали молчания. Неудивительно, что интенсивность всплеска отрицательно коррелировала с периодом амплификации (R = -0,4, P — значения = 0,007), предполагая, что чем выше уровень активности, тем быстрее устанавливалось молчание. Более того, мы провели углубленный анализ, чтобы лучше понять транспозиционную активность среди широко распространенных семейств LTR-RT. Дендрограммы, основанные на множественном выравнивании полноразмерных LTR-RT, были рассчитаны для семейств RLG_famc1 и RLC_famc2 (рисунок S2 в дополнительном файле 1). Для RLG_famc1 это выявило наличие 10 кластеров, указывающих на наличие 10 мастер-копий. Помимо глобального всплеска транспозиции в 1,2 млн лет назад, всплески транспозиции каждого варианта произошли между 0,9и 3,0 млн лет назад. Бимодальное распределение наблюдалось для RLC_famc2 со старым пиком около 7 млн лет назад и недавним пиком 1,45 млн лет назад. Дендрограмма семейства RLC_famc2 выявила присутствие по крайней мере пяти мастер-копий, которые последовательно амплифицируются, подчеркивая тот факт, что сильно повторяющиеся семейства амплифицируются посредством последовательных волн транспозиции, включающих одну или несколько мастер-копий, которые избегают молчания. Чтобы исследовать тип эволюционных сил, сформировавших структуру хромосомы 3B, мы изучили потенциальные различия в хромосомном распределении LTR-RT в зависимости от даты их встраивания.
Более того, мы провели углубленный анализ, чтобы лучше понять транспозиционную активность среди широко распространенных семейств LTR-RT. Дендрограммы, основанные на множественном выравнивании полноразмерных LTR-RT, были рассчитаны для семейств RLG_famc1 и RLC_famc2 (рисунок S2 в дополнительном файле 1). Для RLG_famc1 это выявило наличие 10 кластеров, указывающих на наличие 10 мастер-копий. Помимо глобального всплеска транспозиции в 1,2 млн лет назад, всплески транспозиции каждого варианта произошли между 0,9и 3,0 млн лет назад. Бимодальное распределение наблюдалось для RLC_famc2 со старым пиком около 7 млн лет назад и недавним пиком 1,45 млн лет назад. Дендрограмма семейства RLC_famc2 выявила присутствие по крайней мере пяти мастер-копий, которые последовательно амплифицируются, подчеркивая тот факт, что сильно повторяющиеся семейства амплифицируются посредством последовательных волн транспозиции, включающих одну или несколько мастер-копий, которые избегают молчания. Чтобы исследовать тип эволюционных сил, сформировавших структуру хромосомы 3B, мы изучили потенциальные различия в хромосомном распределении LTR-RT в зависимости от даты их встраивания. Четыре различные категории были определены на основе вставки TE в <1 млн лет назад, от 1 до 2 млн лет назад, от 2 до 3 млн лет назад и> 3 млн лет назад (рис. 4). Анализ показал, что постепенное увеличение доли LTR-RT от теломер к центромере на самом деле объясняется чрезмерной представленностью древних элементов (> 3 млн лет назад). Действительно, не наблюдалось значительных изменений в плотности молодых (<1 млн лет назад) LTR-RT вдоль хромосомы, тогда как в проксимальных областях, вставленных TE, было обнаружено увеличение в 1,3, 2,3 и 2,8 раза по сравнению с дистальными регионами. до 2 млн лет назад, от 2 до 3 млн лет назад и> 3 млн лет назад соответственно. Эти результаты позволяют предположить, что новые вставки TE происходят с одинаковой скоростью вдоль хромосомы и, следовательно, наблюдаемый градиент обусловлен более высокой скоростью элиминации в рекомбиногенных дистальных областях.
Четыре различные категории были определены на основе вставки TE в <1 млн лет назад, от 1 до 2 млн лет назад, от 2 до 3 млн лет назад и> 3 млн лет назад (рис. 4). Анализ показал, что постепенное увеличение доли LTR-RT от теломер к центромере на самом деле объясняется чрезмерной представленностью древних элементов (> 3 млн лет назад). Действительно, не наблюдалось значительных изменений в плотности молодых (<1 млн лет назад) LTR-RT вдоль хромосомы, тогда как в проксимальных областях, вставленных TE, было обнаружено увеличение в 1,3, 2,3 и 2,8 раза по сравнению с дистальными регионами. до 2 млн лет назад, от 2 до 3 млн лет назад и> 3 млн лет назад соответственно. Эти результаты позволяют предположить, что новые вставки TE происходят с одинаковой скоростью вдоль хромосомы и, следовательно, наблюдаемый градиент обусловлен более высокой скоростью элиминации в рекомбиногенных дистальных областях.
Рисунок 3
Дата введения и период амплификации LTR-RT на хромосоме 3B пшеницы. (A) Распределение дат вставки для 5554 полных копий семейства RLG_famc1 (Fatima). Количество копий выделено зеленым цветом (вверху), пик амплификации — красным (посередине), период активности — синим (внизу). (B) Распределение частоты числа копий, дат введения и периода активности с использованием 43 семейств LTR-RT, имеющих не менее 20 копий. 9Рис. 4 Всего 21 165 LTR-RT с предполагаемой датой установки были сгруппированы по четырем классам: от 0 до 1 млн лет назад (синий), от 1 до 2 млн лет назад (фиолетовый), от 2 до 3 млн лет назад (зеленый), >3 млн лет назад (красный) . (A) Распределение количества LTR-RT для каждой из этих четырех категорий вдоль хромосомы 3B. Распределение рассчитывалось в скользящем окне 10 Мб с шагом 1 Мб. Рекомбиногенные дистальные и центромерные/прицентромерные области [42] отмечены серыми и заштрихованными областями соответственно. (B) Коробчатая диаграмма количества TE на 10 Мб скользящего окна, переносимого рекомбиногенными дистальными областями (D), внутренними частями хромосомных плеч (I) и центромерными/прицентромерными областями (C).
(A) Распределение дат вставки для 5554 полных копий семейства RLG_famc1 (Fatima). Количество копий выделено зеленым цветом (вверху), пик амплификации — красным (посередине), период активности — синим (внизу). (B) Распределение частоты числа копий, дат введения и периода активности с использованием 43 семейств LTR-RT, имеющих не менее 20 копий. 9Рис. 4 Всего 21 165 LTR-RT с предполагаемой датой установки были сгруппированы по четырем классам: от 0 до 1 млн лет назад (синий), от 1 до 2 млн лет назад (фиолетовый), от 2 до 3 млн лет назад (зеленый), >3 млн лет назад (красный) . (A) Распределение количества LTR-RT для каждой из этих четырех категорий вдоль хромосомы 3B. Распределение рассчитывалось в скользящем окне 10 Мб с шагом 1 Мб. Рекомбиногенные дистальные и центромерные/прицентромерные области [42] отмечены серыми и заштрихованными областями соответственно. (B) Коробчатая диаграмма количества TE на 10 Мб скользящего окна, переносимого рекомбиногенными дистальными областями (D), внутренними частями хромосомных плеч (I) и центромерными/прицентромерными областями (C).
Изображение полного размера
Одним из распространенных механизмов элиминации LTR-RT является образование соло-LTR посредством эктопической гомологичной рекомбинации между парами LTR [16]. Мы обнаружили 3998 соло-LTR с дупликацией сайта-мишени на псевдомолекуле хромосомы 3B, показывая отношение соло-LTR к интактным элементам 0,13:1, подобное тому, что наблюдалось ранее как у пшеницы (0,14:1) [31], так и у кукурузы. (0,14:1) [44], но значительно ниже, чем у риса (1,39:1) [44]. Второй механизм, участвующий в обороте ТЕ, — это нелегитимная рекомбинация, которая генерирует укороченные ТЕ. На псевдомолекуле обнаружено соотношение укороченных и интактных элементов 3,5:1, что выше, чем соотношение 0,5:1, оцененное ранее для хромосомы 3В [31]. Это в основном из-за большего количества пробелов, обнаруженных в сборке псевдомолекулы, по сравнению с несколькими контигами BAC, последовательность которых была полностью завершена, что привело к предсказанию интактных элементов как усеченных. Более высокое соотношение укороченных и интактных элементов (27:1) было оценено у кукурузы из-за еще большего количества пробелов, особенно в LTR-RT, в последовательности, которая в основном была направлена на завершение генного пространства [47]. Тем не менее, учитывая, что качество сборки однородно вдоль хромосомы 3B, были исследованы локальные вариации соотношения усеченных и интактных. Это выявило закономерность, очень похожую на соотношение одиночных/интактных элементов (рис. S4 в дополнительном файле 1) со значительным увеличением теломерных областей по сравнению с проксимальной областью (односторонний ANOVA, P — значение <0,001), что снова указывает на более быстрый оборот TE в рекомбиногенных областях. Следовательно, доли как соло-LTR, так и укороченных LTR-RT коррелируют со скоростью рекомбинации (R = 0,41 и R = 0,56 соответственно; P -значение <0,001). [13]. Среди 68 цыган семейств, идентифицированных на псевдомолекуле 3B, 7 кодируют интегразу, содержащую хромодомен, и их распределение смещено за счет увеличения проксимальной области (рис.
Более высокое соотношение укороченных и интактных элементов (27:1) было оценено у кукурузы из-за еще большего количества пробелов, особенно в LTR-RT, в последовательности, которая в основном была направлена на завершение генного пространства [47]. Тем не менее, учитывая, что качество сборки однородно вдоль хромосомы 3B, были исследованы локальные вариации соотношения усеченных и интактных. Это выявило закономерность, очень похожую на соотношение одиночных/интактных элементов (рис. S4 в дополнительном файле 1) со значительным увеличением теломерных областей по сравнению с проксимальной областью (односторонний ANOVA, P — значение <0,001), что снова указывает на более быстрый оборот TE в рекомбиногенных областях. Следовательно, доли как соло-LTR, так и укороченных LTR-RT коррелируют со скоростью рекомбинации (R = 0,41 и R = 0,56 соответственно; P -значение <0,001). [13]. Среди 68 цыган семейств, идентифицированных на псевдомолекуле 3B, 7 кодируют интегразу, содержащую хромодомен, и их распределение смещено за счет увеличения проксимальной области (рис. S5 в дополнительном файле 1). Численность gypsy элементов, несущих хромодомен, увеличивается на 80% в проксимальной области, в то время как gypsy элементов без хромодомена увеличивается на 20%, что указывает на то, что сродство хроматина во время транспозиции также может способствовать этому паттерну.
S5 в дополнительном файле 1). Численность gypsy элементов, несущих хромодомен, увеличивается на 80% в проксимальной области, в то время как gypsy элементов без хромодомена увеличивается на 20%, что указывает на то, что сродство хроматина во время транспозиции также может способствовать этому паттерну.
Влияние транспозонов CACTA на эволюцию генного состава посредством дупликации генов
Хромосома 3B несет не менее 2065 генов/псевдогенов, которые не являются синтетическими с родственными модельными геномами злаков B. distachyon , риса и сорго [42]. Эти гены возникли в результате недавних межхромосомных дупликаций (после дивергенции с Brachypodium 39 млн лет назад [46]) и преимущественно накапливались в дистальных областях хромосомы. ДНК-транспозон-опосредованный захват генов, который уже был предложен у пшеницы [31], был выполнен для оценки взаимосвязи между увеличением как CACTA, так и дуплицированных генов в дистальных областях. Чтобы идентифицировать семейства CACTA, в значительной степени связанные с несинтеническими генами, к распределениям семейств CACTA была применена иерархическая кластеризация (см. Материалы и методы; рисунок 5A). Мы выделили две группы, состоящие из 22 и 6 семей (из 30 семей) с противоположными закономерностями. Установлено, что первая группа из 22 семейств более представлена в дистальных отделах (например, семейство Caspar), а вторая, состоящая из шести семейств, более многочисленна в проксимальных отделах (например, 9 семейств).3412 Jorge (семейство) (рис. 5B). Изучение потенциальной специфичной для сайта вставки (в пределах 50 п.н. вокруг элементов) не показало какого-либо предпочтительного сайта вставки ни для одной из этих групп. Кроме того, две группы имеют сходные домены транспозазы. Распределение субтеломерных CACTA сильно коррелировало с распределением несинтенных генов (R = 0,8). Затем мы сравнили их частоту в непосредственной близости (± 20 кб) от несинтенных и синтетических генов (рис. 5C). Это показало, что CACTA, склонные к субтеломерам, в два раза чаще встречаются вблизи несинтенных генов по сравнению с синтетическими. Напротив, для CACTA, склонных к центромерам, различий не наблюдалось.
Материалы и методы; рисунок 5A). Мы выделили две группы, состоящие из 22 и 6 семей (из 30 семей) с противоположными закономерностями. Установлено, что первая группа из 22 семейств более представлена в дистальных отделах (например, семейство Caspar), а вторая, состоящая из шести семейств, более многочисленна в проксимальных отделах (например, 9 семейств).3412 Jorge (семейство) (рис. 5B). Изучение потенциальной специфичной для сайта вставки (в пределах 50 п.н. вокруг элементов) не показало какого-либо предпочтительного сайта вставки ни для одной из этих групп. Кроме того, две группы имеют сходные домены транспозазы. Распределение субтеломерных CACTA сильно коррелировало с распределением несинтенных генов (R = 0,8). Затем мы сравнили их частоту в непосредственной близости (± 20 кб) от несинтенных и синтетических генов (рис. 5C). Это показало, что CACTA, склонные к субтеломерам, в два раза чаще встречаются вблизи несинтенных генов по сравнению с синтетическими. Напротив, для CACTA, склонных к центромерам, различий не наблюдалось. Например, DTC_famc5 ( Vincent ) продемонстрировало шестикратное увеличение промоторной области (5 т.п.о. вверх по течению) несинтенных генов по сравнению с синтетическими генами.
Например, DTC_famc5 ( Vincent ) продемонстрировало шестикратное увеличение промоторной области (5 т.п.о. вверх по течению) несинтенных генов по сравнению с синтетическими генами.
Рисунок 5
Взаимосвязь между семействами CACTA и несинтеническими генами. (A) Дерево , основанное на кластеризации паттернов распределения 30 семейств CACTA, обнаруженных вдоль хромосомы 3B. Ветви, представленные фиолетовым и зеленым цветом, соответствуют семействам CACTA, склонным к субтеломерам, и семействам CACTA, склонным к центромерам, соответственно. (B) Распределение 6 семейств CACTA, склонных к центромерам (вверху) и 22 семейств CACTA, склонных к субтеломерам (внизу), демонстрирующих противоположные закономерности вдоль последовательности хромосом 3B. Серые кривые представляют собой распределение отдельных семейств, а верхние фиолетовые или зеленые кривые представляют совокупную сумму всех семейств. (C) Изобилие центромерных (левая панель) и субтеломерных (правая панель) CACTA вблизи (±20 т. п.н.) синтетических (синий) и несинтеновых генов (красный) соответственно. 0 представляет положение кодирующих последовательностей (стартовый и стоп-кодоны), а среднее содержание CACTA рассчитывали для каждого нуклеотида в окне -20/+20 т.п.н., охватывающем кодирующие последовательности.
п.н.) синтетических (синий) и несинтеновых генов (красный) соответственно. 0 представляет положение кодирующих последовательностей (стартовый и стоп-кодоны), а среднее содержание CACTA рассчитывали для каждого нуклеотида в окне -20/+20 т.п.н., охватывающем кодирующие последовательности.
Увеличить
Выявлено 140 CACTA-опосредованных событий захвата с участием 145 генов и 11 CACTA-семейств (см. Материалы и методы). На семейство DTC_famc5 ( Vincent ) приходится 74% (104) случаев. Захваченные гены были меньше (средний размер кодирующей последовательности (CDS) 488 п.н. по сравнению с 1090 п.н.) и с меньшим количеством экзонов (3,05 против 4,11), чем средние гены на хромосоме 3B. Сорок шесть процентов из них имели функциональную структуру, в то время как остальные были классифицированы как псевдогены. Используя данные экспрессии (РНКсек, выполненный на пяти органах на трех стадиях развития каждый [48]), мы показали, что 26% (38) CACTA-захваченных генов были транскрибированы. Захваченные 145 копий генов представляют 121 различное семейство генов. Интересно, что мы обнаружили два случая, когда один и тот же ген был дважды захвачен двумя разными CACTA. Предполагаемый ген, кодирующий 3′-5′-экзонуклеазу, повторяется в трех копиях DTC_famc5 (9).3412 Vincent ) family (TRAES3BF0
Захваченные 145 копий генов представляют 121 различное семейство генов. Интересно, что мы обнаружили два случая, когда один и тот же ген был дважды захвачен двумя разными CACTA. Предполагаемый ген, кодирующий 3′-5′-экзонуклеазу, повторяется в трех копиях DTC_famc5 (9).3412 Vincent ) family (TRAES3BF0
030CFD_t1, TRAES3BF060400250CFD_t1, TRAES3BF060000130CFD_t1) and in seven copies of the DTC_famc6 family ( TAT ) (TRAES3BF032300010CFD_t1, TRAES3BF032400050CFD_t1, TRAES3BF067500010CFD_t1, TRAES3BF077700050CFD_t1, TRAES3BF082000030CFD_t1, TRAES3BF168400140CFD_t1, TRAES3BF182300010CFD_t1). Высокий уровень сохранности между захваченными сегментами предполагает, что эти две семьи недавно обменялись ДНК.
Нам удалось обнаружить 17 (12%) захваченных генов, которые потенциально происходят в результате перетасовки экзонов с участием 36 родительских генов (см. Материалы и методы). Среди них восемь генов показали экспрессию по крайней мере в одном из проанализированных состояний. Затем мы оценили тип давления отбора, применяемого к тем генам, которые, вероятно, функциональны, путем оценки отношения dN/dS (9).3412 ω ) посредством выравнивания последовательностей с их ближайшим гомологом в B. distachyon . Выяснилось, что большинство захваченных генов находятся в стадии очищающей селекции с соотношением dN/dS в диапазоне от 0,2 до 0,6 (рис. 6). В отличие от распределения ( ω ), наблюдаемого для синтетических и несинтеновых генов, мы наблюдали значительно большую дисперсию для захваченных генов (критерий Фишера, P -значения <10 -5 ), что указывает на более ослабленное давление отбора. на захваченных генах. Всего 19было обнаружено, что захваченные гены (13%) экспрессируются с отношением dN/dS ниже 0,4.
Затем мы оценили тип давления отбора, применяемого к тем генам, которые, вероятно, функциональны, путем оценки отношения dN/dS (9).3412 ω ) посредством выравнивания последовательностей с их ближайшим гомологом в B. distachyon . Выяснилось, что большинство захваченных генов находятся в стадии очищающей селекции с соотношением dN/dS в диапазоне от 0,2 до 0,6 (рис. 6). В отличие от распределения ( ω ), наблюдаемого для синтетических и несинтеновых генов, мы наблюдали значительно большую дисперсию для захваченных генов (критерий Фишера, P -значения <10 -5 ), что указывает на более ослабленное давление отбора. на захваченных генах. Всего 19было обнаружено, что захваченные гены (13%) экспрессируются с отношением dN/dS ниже 0,4.
Рисунок 6
Давление отбора, оцененное по соотношению dN/dS для генов, захваченных CACTA. Распределение частоты соотношения dN/dS для 2964 синтетических генов (синие), 1179 несинтенических генов (красные) и 127 CACTA-захваченных генов на хромосоме 3B (зеленые).
Изображение в полный размер
Основываясь на наших данных о хромосоме 3B, мы подсчитали, что примерно 2500 CACTA-захваченных генов/псевдогенов будут обнаружены в масштабе всего генома, что соответствует диапазону 1,194 гена захвачены Helitron в кукурузе [21] и 2809 — Pack-MULE в рисе [23].
Обсуждение
Отлаженная стратегия построения точных моделей мобильных элементов в очень сложном геноме
Автоматическое и точное аннотирование TE в сложных геномах является сложной задачей. Однако высококачественные аннотации ТЕ необходимы не только для проведения эволюционного анализа и лучшего понимания влияния ТЕ на организацию и экспрессию генома, но и для предотвращения неправильного предсказания генов с клеточными функциями [29].]. Здесь мы разработали стратегию для преодоления некоторых проблем, связанных с чрезмерной фрагментацией прогнозов, обычно наблюдаемых при моделировании TE в больших геномах. Мы использовали знания, накопленные за последние десятилетия [31], [34], [36], [49], для тонкой настройки нашего алгоритма и автоматического восстановления вложенных кластеров, которые еще можно идентифицировать. С помощью CLARI-TE мы смогли предсказать набор из 56 488 интактных TE на хромосоме 3B. Половина крупных интактных ТЕ (> 5 т.п.н.) изначально была предсказана как несколько усеченных фрагментов с помощью поиска сходства, что показало, что в настоящее время абсолютно необходимо курирование для точного определения ТЕ в сложных геномах. Более того, среди 21 165 вставок LTR-RT, которые использовались для изучения динамики вставок/делеций вдоль хромосомы 3B, 30% были вложенными и, таким образом, были бы пропущены без автоматического объединения с помощью CLARI-TE. Использование нашей программы предотвратило смещение данных в сторону недавних вставок TE, как это обычно наблюдается в подходах, основанных на сигнатурах [10], [44]. Наконец, с кураторской библиотекой TE этот подход можно применять к любым сложным геномам (> 50% TE) с вложенными TE.
С помощью CLARI-TE мы смогли предсказать набор из 56 488 интактных TE на хромосоме 3B. Половина крупных интактных ТЕ (> 5 т.п.н.) изначально была предсказана как несколько усеченных фрагментов с помощью поиска сходства, что показало, что в настоящее время абсолютно необходимо курирование для точного определения ТЕ в сложных геномах. Более того, среди 21 165 вставок LTR-RT, которые использовались для изучения динамики вставок/делеций вдоль хромосомы 3B, 30% были вложенными и, таким образом, были бы пропущены без автоматического объединения с помощью CLARI-TE. Использование нашей программы предотвратило смещение данных в сторону недавних вставок TE, как это обычно наблюдается в подходах, основанных на сигнатурах [10], [44]. Наконец, с кураторской библиотекой TE этот подход можно применять к любым сложным геномам (> 50% TE) с вложенными TE.
Доля полных элементов была ниже, чем предполагалось ранее в нашем пилотном исследовании на выбранных BAC из хромосомы 3B [31]: они составляют 22% и 6% для LTR-RT и CACTA, соответственно, по сравнению с 59% и 47% в предыдущая аннотация, созданная вручную. Подобные наблюдения уже были зарегистрированы на кукурузе, где соотношение усеченных и интактных элементов было оценено как 0,5:1 [50], тогда как в аннотации эталонной последовательности генома оно составляло 27:1 [47]. В обоих случаях доля зазоров, отражающая качество сборки, является основным ограничивающим фактором. Действительно, осталось еще 40 459разрывы в псевдомолекуле хромосомы 3В, из которых 57% были включены в ТЕ методом CLARI-TE, а остальные препятствовали восстановлению окружающей структуры ТЕ. Около 85% TE, окружающих разрыв, были аннотированы как усеченные. Кроме того, CACTA являются самыми крупными TE пшеницы (до 30 т.п.н.), очень изменчивы и содержат тандемно повторяющиеся мотивы, особенности, которые делают их наиболее сложным надсемейством для автоматической идентификации.
Подобные наблюдения уже были зарегистрированы на кукурузе, где соотношение усеченных и интактных элементов было оценено как 0,5:1 [50], тогда как в аннотации эталонной последовательности генома оно составляло 27:1 [47]. В обоих случаях доля зазоров, отражающая качество сборки, является основным ограничивающим фактором. Действительно, осталось еще 40 459разрывы в псевдомолекуле хромосомы 3В, из которых 57% были включены в ТЕ методом CLARI-TE, а остальные препятствовали восстановлению окружающей структуры ТЕ. Около 85% TE, окружающих разрыв, были аннотированы как усеченные. Кроме того, CACTA являются самыми крупными TE пшеницы (до 30 т.п.н.), очень изменчивы и содержат тандемно повторяющиеся мотивы, особенности, которые делают их наиболее сложным надсемейством для автоматической идентификации.
Оценки состава ТЕ или организации сложных геномов сильно зависят от эталонной библиотеки ТЕ, используемой в качестве основы для поиска сходства. В этом исследовании аннотация на основе поиска сходства привела к тому, что 85% последовательности 3B были отнесены к TE. Затем 9Идентификация 3412 de novo повторов позволила нам классифицировать дополнительные 3% последовательности как вновь обнаруженные повторы. Такое низкое значение показало, что библиотека ClariTeRep представляет собой почти исчерпывающее представление разнообразия TE, присутствующего на хромосоме 3B, что позволяет предположить, что последующие анализы не были предвзятыми из-за отсутствия знаний о составе TE хромосомы. Хотя три гомеологичных субгенома пшеницы сходны по размеру и, следовательно, имеют сходные пропорции TE, эта пропорция оказалась значительно выше на хромосоме 3B, чем оценки 66% и 67%, полученные для диплоидных геномов T. urartu (AA) [39] и Ae. tauschii (DD) [40]. Такая разница подчеркивает сильное влияние методологии, используемой для аннотирования ТЕ, а не биологическую значимость. Это подтверждается результатами, полученными после применения нашего подхода к моделированию ТЕ к этим двум предварительным последовательностям генома, и обнаружением того, что ТЕ составляют 77% и 74% из них соответственно, то есть пропорции, которые ближе к тому, что мы нашли для хромосомы 3B.
Затем 9Идентификация 3412 de novo повторов позволила нам классифицировать дополнительные 3% последовательности как вновь обнаруженные повторы. Такое низкое значение показало, что библиотека ClariTeRep представляет собой почти исчерпывающее представление разнообразия TE, присутствующего на хромосоме 3B, что позволяет предположить, что последующие анализы не были предвзятыми из-за отсутствия знаний о составе TE хромосомы. Хотя три гомеологичных субгенома пшеницы сходны по размеру и, следовательно, имеют сходные пропорции TE, эта пропорция оказалась значительно выше на хромосоме 3B, чем оценки 66% и 67%, полученные для диплоидных геномов T. urartu (AA) [39] и Ae. tauschii (DD) [40]. Такая разница подчеркивает сильное влияние методологии, используемой для аннотирования ТЕ, а не биологическую значимость. Это подтверждается результатами, полученными после применения нашего подхода к моделированию ТЕ к этим двум предварительным последовательностям генома, и обнаружением того, что ТЕ составляют 77% и 74% из них соответственно, то есть пропорции, которые ближе к тому, что мы нашли для хромосомы 3B. . Основное отличие связано с отсутствием знаний о CACTA в справочной библиотеке TE. Здесь мы предсказали в два-три раза больше CACTA, чем предполагалось ранее (5,44% для T. urartu и 6,01% для Ae. tauschii ), подтверждая влияние эталонной библиотеки TE на биологические интерпретации. Наконец, различия в пропорциях TE, обнаруженные между диплоидными геномами и хромосомой 3B, вероятно, связаны с отсутствием последовательности в черновых последовательностях генома A и D. При расчетных размерах 5,5 Гб и 5 Гб для T. urartu [39] и Ae. tauschii [40],[51], соответственно, TE должны составлять от 80 до 82% генома, учитывая, что низкокопийная ДНК составляет 1 Гб генома [42].
. Основное отличие связано с отсутствием знаний о CACTA в справочной библиотеке TE. Здесь мы предсказали в два-три раза больше CACTA, чем предполагалось ранее (5,44% для T. urartu и 6,01% для Ae. tauschii ), подтверждая влияние эталонной библиотеки TE на биологические интерпретации. Наконец, различия в пропорциях TE, обнаруженные между диплоидными геномами и хромосомой 3B, вероятно, связаны с отсутствием последовательности в черновых последовательностях генома A и D. При расчетных размерах 5,5 Гб и 5 Гб для T. urartu [39] и Ae. tauschii [40],[51], соответственно, TE должны составлять от 80 до 82% генома, учитывая, что низкокопийная ДНК составляет 1 Гб генома [42].
Организация и динамика мобильных элементов
Псевдомолекула 3B размером 774 Мб представляет собой самую большую последовательность хромосом, когда-либо собранную в одну псевдомолекулу. Неравномерное распределение скорости рекомбинации, плотности генов, паттерна экспрессии генов и ТЕ вдоль хромосомы выявило поразительное разделение с пятью отдельными областями: центромерная/перицентромерная область с самой высокой плотностью ТЕ, в которой рекомбинация подавлена; две субтеломерные области с наименьшей плотностью ТЕ, где в основном происходит рекомбинация; и две внутренние части хромосомных плеч с промежуточными признаками [42]. Помимо статического взгляда, подробное изучение TE обеспечило динамическое представление и новое понимание эволюционных сил, которые сформировали это разделение. Во-первых, мы заметили, что LTR-RT вносят основной вклад в неравномерное распределение TE вдоль хромосомы, что является общей чертой сложных геномов, таких как геномы кукурузы [47]. В отличие от геномов других трав, где TE в основном недавно транспонировались, мы обнаружили период основной амплификации 1,5 млн лет назад, за которым последовал период молчания и/или повышенной потери от 1,0 млн лет до настоящего времени, подтверждая, что два события гибридизации, которые привели к к гексаплоидной пшенице не вызывало массивной активации транспозиции. Предыдущие исследования на пшенице показали всплеск транспозиции ТЕ сразу после аллополиплоидизации [36], [52], но, как предполагает Паризод и др. . [53], это, вероятно, явление, ограниченное специфическими семействами TE и в основном молодыми активными популяциями TE. Наличие 21 165 полных LTR-RT позволило нам изучить активность TE в недостижимом до сих пор масштабе, показав, что у каждой семьи был свой период активности.
Помимо статического взгляда, подробное изучение TE обеспечило динамическое представление и новое понимание эволюционных сил, которые сформировали это разделение. Во-первых, мы заметили, что LTR-RT вносят основной вклад в неравномерное распределение TE вдоль хромосомы, что является общей чертой сложных геномов, таких как геномы кукурузы [47]. В отличие от геномов других трав, где TE в основном недавно транспонировались, мы обнаружили период основной амплификации 1,5 млн лет назад, за которым последовал период молчания и/или повышенной потери от 1,0 млн лет до настоящего времени, подтверждая, что два события гибридизации, которые привели к к гексаплоидной пшенице не вызывало массивной активации транспозиции. Предыдущие исследования на пшенице показали всплеск транспозиции ТЕ сразу после аллополиплоидизации [36], [52], но, как предполагает Паризод и др. . [53], это, вероятно, явление, ограниченное специфическими семействами TE и в основном молодыми активными популяциями TE. Наличие 21 165 полных LTR-RT позволило нам изучить активность TE в недостижимом до сих пор масштабе, показав, что у каждой семьи был свой период активности. Таким образом, в целом геном B был сформирован последовательностью волн транспозиций из разных семейств, некоторые из которых избежали молчания, а не массовой реактивацией всех TE одновременно. Подобные волны амплификации уже были описаны, например, у сои [44], и, очевидно, наблюдаются в геномах, где LTR-RT не были быстро устранены.
Таким образом, в целом геном B был сформирован последовательностью волн транспозиций из разных семейств, некоторые из которых избежали молчания, а не массовой реактивацией всех TE одновременно. Подобные волны амплификации уже были описаны, например, у сои [44], и, очевидно, наблюдаются в геномах, где LTR-RT не были быстро устранены.
Распределение времени вставки TE вдоль хромосомы показало неравномерный характер, что в основном связано с дифференциальным расположением старых LTR-RT (тех, которые> 3 млн лет назад). Напротив, недавно вставленные элементы (<1 млн лет назад) демонстрировали гораздо более равномерное распределение, предполагая, что транспозиция происходила с одинаковой скоростью вдоль хромосомы и что уменьшение плотности TE по направлению к теломерам скорее отражает быструю элиминацию в рекомбиногенных дистальных областях. Аналогичные выводы были сделаны для геномов сорго [12] и кукурузы [47], тогда как для более компактных геномов, таких как Arabidopsis , обогащение LTR-RTs в центромерных областях было объяснено отбором против вставки разрушающих TE в богатые генами области [54]. Дополнительные доказательства более быстрой элиминации TE на концах хромосом включают чрезмерное представительство одиночных LTR и укороченных LTR-RT. Это говорит о том, что неравноправная гомологичная рекомбинация (генерация одиночных LTR) и нелегитимная рекомбинация (генерация укороченных TE) чаще встречаются в дистальных рекомбиногенных областях, как это наблюдается у риса [18]. В отличие от LTR-RT, плотность транспозонов ДНК класса II увеличивалась в дистальных областях и положительно коррелировала как с плотностью генов, так и со скоростью рекомбинации. Такая корреляция также наблюдалась у сорго [12] и кукурузы [4], но не у риса [18]. Хорошо известно, что неавтономные ДНК-транспозоны связаны с генами [55], [56], и предполагается их роль в регуляции экспрессии генов [8], [57]. У пшеницы, за исключением CACTA, ДНК-транспозоны короче, чем элементы класса I, и их встраивание в области, богатые генами, может подвергаться встречному отбору с более низкой частотой. Кроме того, более быстрый оборот TE в дистальных регионах, предложенный выше, может также объяснить увеличение плотности ДНК-транспозонов в этих регионах как простое следствие уплотнения межгенного пространства, которое в основном формируется LTR-RTs.
Дополнительные доказательства более быстрой элиминации TE на концах хромосом включают чрезмерное представительство одиночных LTR и укороченных LTR-RT. Это говорит о том, что неравноправная гомологичная рекомбинация (генерация одиночных LTR) и нелегитимная рекомбинация (генерация укороченных TE) чаще встречаются в дистальных рекомбиногенных областях, как это наблюдается у риса [18]. В отличие от LTR-RT, плотность транспозонов ДНК класса II увеличивалась в дистальных областях и положительно коррелировала как с плотностью генов, так и со скоростью рекомбинации. Такая корреляция также наблюдалась у сорго [12] и кукурузы [4], но не у риса [18]. Хорошо известно, что неавтономные ДНК-транспозоны связаны с генами [55], [56], и предполагается их роль в регуляции экспрессии генов [8], [57]. У пшеницы, за исключением CACTA, ДНК-транспозоны короче, чем элементы класса I, и их встраивание в области, богатые генами, может подвергаться встречному отбору с более низкой частотой. Кроме того, более быстрый оборот TE в дистальных регионах, предложенный выше, может также объяснить увеличение плотности ДНК-транспозонов в этих регионах как простое следствие уплотнения межгенного пространства, которое в основном формируется LTR-RTs. Эта дифференциальная частота делеций может также объяснить увеличение разнообразия TE. Такой паттерн был описан у кукурузы, где центромера воспринималась как среда, заселенная только «особями», наиболее приспособленными к размножению, создавая бедную разнообразием экосистему [47]. Наконец, предпочтительная вставка TE, по-видимому, является потенциальной движущей силой разделения хромосомы 3B с семью цыган из семей, имеющих хромодоменсодержащую интегразу [13], значительно сконцентрированную в проксимальном отделе.
Эта дифференциальная частота делеций может также объяснить увеличение разнообразия TE. Такой паттерн был описан у кукурузы, где центромера воспринималась как среда, заселенная только «особями», наиболее приспособленными к размножению, создавая бедную разнообразием экосистему [47]. Наконец, предпочтительная вставка TE, по-видимому, является потенциальной движущей силой разделения хромосомы 3B с семью цыган из семей, имеющих хромодоменсодержащую интегразу [13], значительно сконцентрированную в проксимальном отделе.
Влияние транспозонов CACTA на дупликацию генов в пшенице
ДНК-транспозоны составляют 18% последовательности хромосом 3B, что является самой высокой долей среди секвенированных геномов трав. CACTA вносят основной вклад, составляя 16%, в то время как на них приходится только от 2,2% до 5,9% в сорго, рисе, Brachypodium , кукурузе и ячмене [4], [11], [46], [58]. Это подтверждает гипотезу о том, что CACTA были амплифицированы именно в линии пшеницы. Как правило, размер генома в основном коррелирует с элементами класса I — например, LINEs у человека [59].] и LTR-RT в растениях [60], [61] — из-за их механизма транспозиции копирования и вставки, позволяющего увеличить количество за короткий период времени [62], [63]. Таким образом, среди растений геном пшеницы является редким примером массовой амплификации транспозонов вырезания и вставки.
Как правило, размер генома в основном коррелирует с элементами класса I — например, LINEs у человека [59].] и LTR-RT в растениях [60], [61] — из-за их механизма транспозиции копирования и вставки, позволяющего увеличить количество за короткий период времени [62], [63]. Таким образом, среди растений геном пшеницы является редким примером массовой амплификации транспозонов вырезания и вставки.
Интересно, что 22 семейства CACTA оказались преимущественно связанными с несинтеническими генами, то есть с генами, которые были перемещены в результате недавних событий дупликации в новое положение хромосомы. Предыдущие исследования на сое [64], сорго [12] и Ipomoea tricolor [65] показали, что CACTA могут захватывать гены и их фрагменты. Здесь мы идентифицировали 145 CACTA-захваченных генов на хромосоме 3B (2% содержания генов). Хотя большинство из них были фрагментами генов, как уже наблюдалось в меньшем масштабе [66], 13% были как транскрибированы, так и подвергались очищающему отбору, предполагая, что они функциональны, а 12%, вероятно, возникли в результате перетасовки экзонов. Было доказано, что помимо механизмов захвата генов, CACTA опосредуют дупликацию генов у пшеницы за счет репарации двухцепочечных разрывов, возникающих во время вставки [66]. Преимущественная ассоциация CACTA с несинтеническими генами может отражать более высокую скорость дупликации генов из-за высокой частоты вставки CACTA. Это исследование подчеркивает важность CACTA для дупликации генов и создания новых генов, которые могут быть связаны с адаптацией пшеницы к различным условиям окружающей среды [42]. Подобные примеры с участием транспозонов класса II были описаны с мутаторами в рисе [23], [67] и гелитронами в кукурузе [21], [22]. Следовательно, похоже, что суперсемейства, участвующие в захвате генов, имеют тенденцию к размножению и эволюционному успеху.
Было доказано, что помимо механизмов захвата генов, CACTA опосредуют дупликацию генов у пшеницы за счет репарации двухцепочечных разрывов, возникающих во время вставки [66]. Преимущественная ассоциация CACTA с несинтеническими генами может отражать более высокую скорость дупликации генов из-за высокой частоты вставки CACTA. Это исследование подчеркивает важность CACTA для дупликации генов и создания новых генов, которые могут быть связаны с адаптацией пшеницы к различным условиям окружающей среды [42]. Подобные примеры с участием транспозонов класса II были описаны с мутаторами в рисе [23], [67] и гелитронами в кукурузе [21], [22]. Следовательно, похоже, что суперсемейства, участвующие в захвате генов, имеют тенденцию к размножению и эволюционному успеху.
Заключение
В этом исследовании мы аннотировали ТЕ и их вложенный паттерн в одном из самых сложных геномов. Наша автоматизированная процедура значительно повысила точность прогнозов TE по сравнению с классическим подходом поиска сходства. Такая высококачественная аннотация позволила нам определить и проанализировать характер вставки TE, разнообразие и время вставки и показала, что разделение хромосомы в основном определяется более высокими скоростями делеций, которые быстрее в областях рекомбинации. Мы обнаружили неожиданное изобилие CACTA и обнаружили значительную связь с недавно продублированными генами, что свидетельствует о серьезном влиянии этих элементов на пластичность генома посредством создания генов. Такой механизм мог предоставить пшенице выгодную способность адаптироваться к широкому диапазону окружающей среды.
Такая высококачественная аннотация позволила нам определить и проанализировать характер вставки TE, разнообразие и время вставки и показала, что разделение хромосомы в основном определяется более высокими скоростями делеций, которые быстрее в областях рекомбинации. Мы обнаружили неожиданное изобилие CACTA и обнаружили значительную связь с недавно продублированными генами, что свидетельствует о серьезном влиянии этих элементов на пластичность генома посредством создания генов. Такой механизм мог предоставить пшенице выгодную способность адаптироваться к широкому диапазону окружающей среды.
Материалы и методы
Создание классифицированной библиотеки последовательностей мобильных элементов
Triticeae
Библиотека последовательностей ТЕ, предназначенная для аннотации ТЕ на основе поиска сходства в геноме пшеницы, была создана, как описано в Choulet et al . [42]. Вкратце, мы извлекли 3159 известных полноразмерных последовательностей ТЕ, то есть элементов, имеющих концевые повторы (концевые инвертированные повторы или LTR) и/или признаки, типичные для полных LINE /9. 3413 СИНУСОВ. Мы построили 16 групп, соответствующих каждому суперсемейству, и небольшие неавтономные MITE были сгруппированы отдельно от их автономных аналогов, чтобы избежать вычисления множественных выравниваний с последовательностями очень разных размеров. Для каждой из полученных 16 групп было выполнено сравнение всех по всем BLAST [68] (без фильтрации последовательностей низкой сложности). Выходные данные BLAST анализировали с помощью MCL (опция -I 1.2) [69] для создания кластеров последовательностей, имеющих сходство. Параметр -I, контролирующий степень детализации кластера, был установлен на 1,2 для «очень грубой кластеризации», что означает, что на этом этапе были построены большие кластеры. Эти кластеры использовались для определения уровня семьи. Семьи из трех и более членов рассматривались для расчета множественного выравнивания с использованием MAFFT (параметр по умолчанию) [70]. Затем был применен этап ручного курирования. Мы использовали Jalview [71] в качестве инструмента визуализации для ручного управления множественными выравниваниями и их соответствующим соседним деревом соединения.
3413 СИНУСОВ. Мы построили 16 групп, соответствующих каждому суперсемейству, и небольшие неавтономные MITE были сгруппированы отдельно от их автономных аналогов, чтобы избежать вычисления множественных выравниваний с последовательностями очень разных размеров. Для каждой из полученных 16 групп было выполнено сравнение всех по всем BLAST [68] (без фильтрации последовательностей низкой сложности). Выходные данные BLAST анализировали с помощью MCL (опция -I 1.2) [69] для создания кластеров последовательностей, имеющих сходство. Параметр -I, контролирующий степень детализации кластера, был установлен на 1,2 для «очень грубой кластеризации», что означает, что на этом этапе были построены большие кластеры. Эти кластеры использовались для определения уровня семьи. Семьи из трех и более членов рассматривались для расчета множественного выравнивания с использованием MAFFT (параметр по умолчанию) [70]. Затем был применен этап ручного курирования. Мы использовали Jalview [71] в качестве инструмента визуализации для ручного управления множественными выравниваниями и их соответствующим соседним деревом соединения. Последовательности, приводящие к ошибкам в множественных выравниваниях (из-за инверсий, делеций или вставок), идентифицировали и отбрасывали, так что все выравнивания были исправлены. Кроме того, поскольку MCL сгруппировали последовательности внутри больших кластеров, мы выявили четко обособленные монофилетические группы (по соседнему дереву соединения) среди каждого отдельного семейства и, следовательно, определили варианты внутри семейства; например, семейство RLG_famc8 состоит из трех вариантов, называемых RLG_famc8.1, RLG_famc8.2 и RLG_famc8.3. Мы назвали библиотеку ClariTeRep, и она доступна по запросу.
Последовательности, приводящие к ошибкам в множественных выравниваниях (из-за инверсий, делеций или вставок), идентифицировали и отбрасывали, так что все выравнивания были исправлены. Кроме того, поскольку MCL сгруппировали последовательности внутри больших кластеров, мы выявили четко обособленные монофилетические группы (по соседнему дереву соединения) среди каждого отдельного семейства и, следовательно, определили варианты внутри семейства; например, семейство RLG_famc8 состоит из трех вариантов, называемых RLG_famc8.1, RLG_famc8.2 и RLG_famc8.3. Мы назвали библиотеку ClariTeRep, и она доступна по запросу.
Оценка точности предсказания мобильных элементов
Мы использовали каркас размером 904 кб из хромосомы 3B пшеницы, который не соответствует ранее известной области генома, в качестве тестовой последовательности для оценки точности моделирования ТЕ. Этот эталонный каркас содержит 196 ТЕ, покрывающих 91% последовательности, с 47 вложенными вставками. Чтобы автоматизировать сравнение автоматических и ручных прогнозов TE и расчет значений чувствительности и специфичности, мы разработали compareAnnotTE. pl 9.3412 . Чувствительность и специфичность оценивались на трех различных уровнях: нуклеотид, признак и вложенный признак. На уровне нуклеотидов каждый нуклеотид рассматривался для расчета чувствительности и специфичности. На уровне признаков учитывались только границы ТЭ (все сегменты ТЭ, разделенные на несколько частей вложенными вставками). На уровне вложенных объектов программа рассматривает границы вложенных TE для оценки точности реконструкции вложенных кластеров. На уровне признаков и вложенных признаков предсказанный признак считался истинно положительным, если его границы соответствовали выбранным вручную позициям TE в диапазоне 10 п.н.
pl 9.3412 . Чувствительность и специфичность оценивались на трех различных уровнях: нуклеотид, признак и вложенный признак. На уровне нуклеотидов каждый нуклеотид рассматривался для расчета чувствительности и специфичности. На уровне признаков учитывались только границы ТЭ (все сегменты ТЭ, разделенные на несколько частей вложенными вставками). На уровне вложенных объектов программа рассматривает границы вложенных TE для оценки точности реконструкции вложенных кластеров. На уровне признаков и вложенных признаков предсказанный признак считался истинно положительным, если его границы соответствовали выбранным вручную позициям TE в диапазоне 10 п.н.
Поиск сходства и автоматическое курирование с помощью CLARI-TE
Мы применили нашу процедуру к 2808 каркасам, собранным для хромосомы 3B (HG670306 и CBUC010000001-CBUC010001450), а также к T. urartu [39] и Ae. tauschii геномов [40]. Каждая последовательность была исследована на содержание TE с использованием RepeatMasker (механизм cross_match с параметрами по умолчанию) [72] с ClariTeRep. Мы разработали CLARI-TE, программу на Perl [73],[74], для исправления необработанных результатов поиска сходства. Он выполняет три следующих шага. Во-первых, разрешение перекрывающихся прогнозов. Чтобы устранить перекрытие между двумя прогнозами, приоритет был отдан тому прогнозу, который охватывает оконечность TE. Если ни один из прогнозов или оба не охватывают окончание TE, приоритет отдается сохранению самого длинного прогноза и пересчету позиций другого. Во-вторых, слияние прогнозов. Фрагментация ТЕ-моделей связана с наличием пробелов в каркасах и с тем, что вновь идентифицированная ТЕ-копия может расходиться с эталонным элементом, так что один элемент не предсказывается как единое целое, а разделяется на несколько частей, совпадающих друг с другом. различные части элементов одного семейства. В этом случае все соседние фрагменты, относящиеся к одному и тому же семейству, были объединены в один объект, если соблюдалась коллинеарность совпадающих сегментов, за исключением совпадающих сегментов LTR.
Мы разработали CLARI-TE, программу на Perl [73],[74], для исправления необработанных результатов поиска сходства. Он выполняет три следующих шага. Во-первых, разрешение перекрывающихся прогнозов. Чтобы устранить перекрытие между двумя прогнозами, приоритет был отдан тому прогнозу, который охватывает оконечность TE. Если ни один из прогнозов или оба не охватывают окончание TE, приоритет отдается сохранению самого длинного прогноза и пересчету позиций другого. Во-вторых, слияние прогнозов. Фрагментация ТЕ-моделей связана с наличием пробелов в каркасах и с тем, что вновь идентифицированная ТЕ-копия может расходиться с эталонным элементом, так что один элемент не предсказывается как единое целое, а разделяется на несколько частей, совпадающих друг с другом. различные части элементов одного семейства. В этом случае все соседние фрагменты, относящиеся к одному и тому же семейству, были объединены в один объект, если соблюдалась коллинеарность совпадающих сегментов, за исключением совпадающих сегментов LTR. Позиции LTR эталонных TE были аннотированы в нашей библиотеке, и эта информация учитывалась в процессе слияния. В-третьих, реконструкция вложенных ТЭ. Мы разработали процедуру соединения отдельных объектов, которые являются частью одного и того же TE и разделены вложенными вставками. Объединение было разрешено, когда два сегмента, соответствующие одному и тому же семейству (относительно коллинеарности между прогнозируемым и эталонным TE), разделены максимум 10 прогнозируемыми TE. Завершающим этапом аннотации является сопоставление неповрежденных полноразмерных и фрагментированных ТЕ. Неповрежденные полноразмерные TE — это прогнозы, охватывающие не менее 90% эталонных полных ТЕ в библиотеке, для которых были идентифицированы оба конца (в диапазоне 50 нуклеотидов). Более того, для каждого полного элемента был проведен поиск доменов PFAM для обнаружения хромодоменов и транспозазоподобных доменов.
Позиции LTR эталонных TE были аннотированы в нашей библиотеке, и эта информация учитывалась в процессе слияния. В-третьих, реконструкция вложенных ТЭ. Мы разработали процедуру соединения отдельных объектов, которые являются частью одного и того же TE и разделены вложенными вставками. Объединение было разрешено, когда два сегмента, соответствующие одному и тому же семейству (относительно коллинеарности между прогнозируемым и эталонным TE), разделены максимум 10 прогнозируемыми TE. Завершающим этапом аннотации является сопоставление неповрежденных полноразмерных и фрагментированных ТЕ. Неповрежденные полноразмерные TE — это прогнозы, охватывающие не менее 90% эталонных полных ТЕ в библиотеке, для которых были идентифицированы оба конца (в диапазоне 50 нуклеотидов). Более того, для каждого полного элемента был проведен поиск доменов PFAM для обнаружения хромодоменов и транспозазоподобных доменов.
Оценка даты вставки LTR-RT и филогении
Мы использовали программу TRsearch от REPET [45] для определения положения как 5′-, так и 3′-LTR из полного элемента. Мы отбросили предсказанные LTR, которые не соответствовали краю элемента (в диапазоне 50 п.н.). Пары LTR были выровнены с использованием MUSCLE [75], а даты включения LTR-RT были оценены с учетом частоты мутаций 1,3 × 10 -8 замен/сайт/год [76]. Наконец, с помощью R было построено распределение дат вставки для каждой семьи с 20 или более копиями с предполагаемой датой. Для каждого распределения была определена дата пика всплеска, и период активности был рассчитан с учетом самого короткого периода времени, содержащего более 80% датированных вставок. Филогенез был установлен путем вычисления множественных выравниваний всех интактных LTR-RT, принадлежащих семействам RLG_famc1 и RLC_famc2, с использованием MAFFT [70]. Затем с помощью FasTree [77] было построено дерево объединения соседей. Дерево было нарисовано с помощью figtree 1.4.2 [78].
Мы отбросили предсказанные LTR, которые не соответствовали краю элемента (в диапазоне 50 п.н.). Пары LTR были выровнены с использованием MUSCLE [75], а даты включения LTR-RT были оценены с учетом частоты мутаций 1,3 × 10 -8 замен/сайт/год [76]. Наконец, с помощью R было построено распределение дат вставки для каждой семьи с 20 или более копиями с предполагаемой датой. Для каждого распределения была определена дата пика всплеска, и период активности был рассчитан с учетом самого короткого периода времени, содержащего более 80% датированных вставок. Филогенез был установлен путем вычисления множественных выравниваний всех интактных LTR-RT, принадлежащих семействам RLG_famc1 и RLC_famc2, с использованием MAFFT [70]. Затем с помощью FasTree [77] было построено дерево объединения соседей. Дерево было нарисовано с помощью figtree 1.4.2 [78].
Распределение мобильных элементов по хромосоме
Распределение ТЕ по последовательности хромосомы 3В рассчитывали путем расчета доли (по размеру) и количества ТЕ в скользящем окне размером 10 Мб с шагом 1 Мб. Распределение разнообразия ТЕ вдоль хромосомы рассчитывали с использованием того же окна путем подсчета числа семей в окне. Чтобы предотвратить резкие изменения из-за неправильных прогнозов, мы рассмотрели количество семей, представляющих 99% фракции ТЭ на окно (N99).
Распределение разнообразия ТЕ вдоль хромосомы рассчитывали с использованием того же окна путем подсчета числа семей в окне. Чтобы предотвратить резкие изменения из-за неправильных прогнозов, мы рассмотрели количество семей, представляющих 99% фракции ТЭ на окно (N99).
Прогнозирование одиночных LTR
На основе 30 406 интактных LTR-RT, предсказанных на хромосоме 3B, мы создали библиотеку последовательностей LTR путем извлечения 18 928 LTR, фланкированных каноническими 5′-TG и 3′-CA динуклеотидами. Эта библиотека использовалась для дополнительного раунда поиска сходства с использованием RepeatMasker на полной хромосоме 3B. Чтобы отличить одиночные LTR от укороченных LTR-RT, мы специально искали наличие дупликации целевого сайта размером 5 п.н. (допускается изменение одного нуклеотида), фланкирующего совпадающую область.
Иерархическая кластеризация распределений
Для выявления семейств CACTA со схожими распределениями вдоль хромосомы была проведена иерархическая кластеризация распределений, рассчитанных в скользящем окне размером 10 Мб (шаг 1 Мб) с использованием R-пакета ‘pvclust [79]. Мы учитывали только семьи, представляющие не менее 0,01% хотя бы в одном окне размером 10 МБ. Корреляции Пирсона были рассчитаны между каждой парой распределения, и была применена кластеризация с помощью агломеративного метода «усреднение» (N = 10 000 повторных выборок начальной загрузки).
Мы учитывали только семьи, представляющие не менее 0,01% хотя бы в одном окне размером 10 МБ. Корреляции Пирсона были рассчитаны между каждой парой распределения, и была применена кластеризация с помощью агломеративного метода «усреднение» (N = 10 000 повторных выборок начальной загрузки).
Численность мобильных элементов вблизи генов
Положения CDS аннотированных генов, кодирующих белок хромосомы 3B, использовали для оценки относительной численности семейств TE в 20 т.п.о. выше и ниже по течению областей. Средняя доля данного семейства TE была рассчитана для каждого положения нуклеотида в окружающей последовательности CDS с учетом ориентации генов.
Обнаружение событий перетасовки генов и экзонов, захваченных мобильными элементами
Чтобы обнаружить захваченные TE гены, мы выделили гены, фланкированные двумя элементами, принадлежащими к одному и тому же семейству, как след потенциального события захвата. Всего было обнаружено 558 событий потенциального захвата генов, 235 (42%) с участием CACTA, 104 (19%) с участием цыган и 219 (39%) с участием других надсемейств. Мы вручную проверяли наличие дупликаций сайтов-мишеней как доказательство захвата генов.
Мы вручную проверяли наличие дупликаций сайтов-мишеней как доказательство захвата генов.
Чтобы расшифровать потенциальные события перетасовки экзонов, мы искали присутствие химерных генов. Поиск подобия с использованием BLASTP против 9Протеом 3412 B. distachyon выполняли для каждого продукта захваченного гена. Белки пшеницы, у которых более 70% их длины выравниваются с белком B. distachyon , отфильтровывали. Для остальных мы разрабатываем процедуру синтаксического анализа для определения перекрывающихся областей сходства между белком B. distachyon и нашей последовательностью запроса и для обнаружения химерных белков, то есть белков, демонстрирующих неперекрывающиеся сегменты сходства с различными B. белки дистахион .
Наличие данных
Последовательности и аннотации эталонной псевдомолекулы и неназначенных каркасов были депонированы в Европейском архиве нуклеотидов (ENA; проект PRJEB4376) под номерами доступа HG670306 и CBUC010000001 до CBUC010001450 соответственно. Исходный код программы CLARI-TE доступен по ссылке [74].
Исходный код программы CLARI-TE доступен по ссылке [74].
Дополнительный файл
Сокращения
- BAC:
бактериальная искусственная хромосома
- CDS:
кодовая последовательность
- ЛИНИЯ:
длинный вкрапленный ядерный элемент
- Литр:
длинный терминальный повтор
- LTR-RT:
длинный концевой повтор ретротранспозона
- КЛАСТЬ:
миниатюрный мобильный элемент с инвертированным повтором
- млн лет назад:
миллиона лет назад
- СИНУС:
короткий вкрапленный ядерный элемент
- ТЕ:
сменный элемент
- ТРЭП:
Triticeae База данных последовательностей REPeat
Ссылки
- «>
McClintock B: Происхождение и поведение мутабельных локусов в кукурузе. Proc Natl Acad Sci U S A. 1950, 36: 344-355. 10.1073/пнас.36.6.344.
ПабМед
ПабМед Центральный
Статья
Google ученый
Feschotte C, Jiang N, Wessler SR: Мобильные элементы растений: где генетика встречается с геномикой. Нат Рев Жене. 2002, 3: 329-341. 10.1038/nrg793.
ПабМед
Статья
Google ученый
Arabidopsis GI: Анализ последовательности генома цветкового растения Arabidopsis thaliana. Природа. 2000, 408: 796-10.1038/35048692.
Артикул
Google ученый
Schnable PS, Ware D, Fulton RS, Stein JC, Wei F, Pasternak S, Liang C, Zhang J, Fulton L, Graves TA: Геном кукурузы B73: сложность, разнообразие и динамика. Наука. 2009 г., 326: 1112-1115. 10.1126/научн. 1178534.
1178534.
ПабМед
Статья
Google ученый
Девос К.М.: Организация и эволюция генома травы. Curr Opin Plant Biol. 2010, 13: 139-145. 10.1016/j.pbi.2009.12.005.
ПабМед
Статья
Google ученый
Беннетцен Дж. Л., Ма Дж., Девос К. М.: Механизмы недавних изменений размера генома у цветковых растений. Энн Бот. 2005, 95: 127-132. 10.1093/аоб/mci008.
ПабМед
ПабМед Центральный
Статья
Google ученый
Тенайлон М.И., Холлистер Дж.Д., Гаут Б.С.: Триптих эволюции мобильных элементов растений. Тенденции Растениевод. 2010, 15: 471-478. 10.1016/ж.трастения.2010.05.003.
ПабМед
Статья
Google ученый
Найто К., Чжан Ф., Цукияма Т., Сайто Х., Хэнкок К. Н., Ричардсон А.О., Окумото Ю., Танисака Т., Весслер С.Р.: Неожиданные последствия внезапной и массивной амплификации транспозонов на экспрессию генов риса. Природа. 2009 г., 461: 1130-1134. 10.1038/природа08479.
Н., Ричардсон А.О., Окумото Ю., Танисака Т., Весслер С.Р.: Неожиданные последствия внезапной и массивной амплификации транспозонов на экспрессию генов риса. Природа. 2009 г., 461: 1130-1134. 10.1038/природа08479.
ПабМед
Статья
Google ученый
Li B, Choulet F, Heng Y, Hao W, Paux E, Liu Z, Yue W, Jin W, Feuillet C, Zhang X: Центромерные ретротранспозоны пшеницы: новые играют важную роль в центромерной структуре. Плант Дж. 2013, 73: 952-965. 10.1111/tpj.12086.
ПабМед
Статья
Google ученый
Vitte C, Bennetzen JL: Анализ структурного разнообразия ретротранспозонов раскрывает свойства и склонности в эволюции генома покрытосеменных растений. Proc Natl Acad Sci USA. 2006, 103: 17638-17643. 10.1073/пнас.0605618103.
ПабМед
ПабМед Центральный
Статья
Google ученый
Мацумото Т., Ву Дж., Канамори Х., Катайосе Ю., Фудзисава М., Намики Н., Мидзуно Х., Ямамото К., Антонио Б.А., Баба Т. Последовательность генома риса на основе карты. Природа. 2005, 436: 793-800. 10.1038/природа03895.
Артикул
Google ученый
Патерсон А.Х., Бауэрс Дж.Е., Бруггманн Р., Дубчак И., Гримвуд Дж., Гундлах Х., Хаберер Г., Хеллстен У., Митрос Т., Поляков А.: Геном сорго двухцветного и диверсификация трав. Природа. 2009 г., 457: 551-556. 10.1038/природа07723.
ПабМед
Статья
Google ученый
Gao X, Hou Y, Ebina H, Levin HL, Voytas DF: Хромодомены направляют интеграцию ретротранспозонов в гетерохроматин. Геном Res. 2008, 18: 359-369. 10.1101/гр.7146408.
ПабМед
ПабМед Центральный
Статья
Google ученый
Marín I, Lloréns C: Ретротранспозоны Ty3/Gypsy: описание новых элементов Arabidopsis thaliana и перспективы эволюции, полученные на основе сравнительных геномных данных. Мол Биол Эвол. 2000, 17: 1040-1049. 10.1093/oxfordjournals.molbev.a026385.
Мол Биол Эвол. 2000, 17: 1040-1049. 10.1093/oxfordjournals.molbev.a026385.
ПабМед
Статья
Google ученый
Chatterjee AG, Leem YE, Kelly FD, Levin HL: Хромодомен интегразы Tf1 способствует связыванию с кДНК и опосредует выбор сайта-мишени. Дж Вирол. 2009, 83: 2675-2685. 10.1128/ОВИ.01588-08.
ПабМед
ПабМед Центральный
Статья
Google ученый
Девос К.М., Браун Дж.К., Беннетцен Дж.Л.: Уменьшение размера генома за счет незаконной рекомбинации противодействует расширению генома у арабидопсиса. Геном Res. 2002, 12: 1075-1079. 10.1101/гр.132102.
ПабМед
ПабМед Центральный
Статья
Google ученый
Ma J, Devos KM, Bennetzen JL: Анализ структур LTR-ретротранспозонов выявил недавнюю и быструю потерю геномной ДНК у риса. Геном Res. 2004, 14: 860-869. 10.1101/гр.1466204.
2004, 14: 860-869. 10.1101/гр.1466204.
ПабМед
ПабМед Центральный
Статья
Google ученый
Tian Z, Rizzon C, Du J, Zhu L, Bennetzen JL, Jackson SA, Gaut BS, Ma J: Генетическая рекомбинация и плотность генов формируют характер элиминации ДНК в ретротранспозонах с длинными концевыми повторами риса?. Геном Res. 2009 г., 19: 2221-2230. 10.1101/гр.083899.108.
ПабМед
ПабМед Центральный
Статья
Google ученый
Duret L, Marais G, Biémont C: Транспозоны, но не ретротранспозоны, расположены преимущественно в областях с высокой скоростью рекомбинации у Caenorhabditis elegans. Генетика. 2000, 156: 1661-1669.
ПабМед
ПабМед Центральный
Google ученый
Лонг М., Бетран Э., Торнтон К., Ван В.: Происхождение новых генов: взгляды молодых и старых. Нат Рев Жене. 2003, 4: 865-875. 10.1038/nrg1204.
Нат Рев Жене. 2003, 4: 865-875. 10.1038/nrg1204.
ПабМед
Статья
Google ученый
Ян Л., Беннетцен Дж.Л.: Распространение, разнообразие, эволюция и выживание гелитронов в геноме кукурузы. Proc Natl Acad Sci USA. 2009, 106: 19922-19927. 10.1073/пнас.08106.
ПабМед
ПабМед Центральный
Статья
Google ученый
Морганте М., Бруннер С., Пи Г., Фенглер К., Зукколо А., Рафальски А.: Дупликация генов и перетасовка экзонов с помощью гелитроноподобных транспозонов создают внутривидовое разнообразие кукурузы. Нат Жене. 2005, 37:997-1002. 10.1038/нг1615.
ПабМед
Статья
Google ученый
Ханада К., Вальехо В., Нобута К., Слоткин Р.К., Лиш Д., Мейерс Б.С., Шиу С.Х., Цзян Н.: Функциональная роль пакетных MULE в рисе, выведенная на основе очищающего отбора и профиля экспрессии. Растительная клетка. 2009, 21: 25-38. 10.1105/тпк.108.063206.
Растительная клетка. 2009, 21: 25-38. 10.1105/тпк.108.063206.
ПабМед
ПабМед Центральный
Статья
Google ученый
Цзян Н., Весслер С.Р.: Предпочтение вставки мобильных элементов кукурузы и риса с миниатюрными перевернутыми повторяющимися элементами, выявленное в результате анализа вложенных элементов. Растительная клетка. 2001, 13: 2553-2564. 10.1105/тпк.13.11.2553.
ПабМед
ПабМед Центральный
Статья
Google ученый
Juretic N, Bureau TE, Bruskiewich RM: Аннотация мобильных элементов генома риса. Биоинформатика. 2004, 20: 155-160. 10.1093/биоинформатика/bth019.
ПабМед
Статья
Google ученый
Jiang N, Feschotte C, Zhang X, Wessler SR: Использование риса для понимания происхождения и амплификации миниатюрных инвертированных повторяющихся мобильных элементов (MITE). Curr Opin Plant Biol. 2004, 7: 115-119. 10.1016/j.pbi.2004.01.004.
Curr Opin Plant Biol. 2004, 7: 115-119. 10.1016/j.pbi.2004.01.004.
ПабМед
Статья
Google ученый
Lu C, Chen J, Zhang Y, Hu Q, Su W, Kuang H: Миниатюрные перевернутые-повторяющиеся мобильные элементы (MITE) были накоплены в результате всплесков амплификации и играют важную роль в экспрессии генов и видовом разнообразии Oryza sativa. . Мол Биол Эвол. 2012, 29: 1005-1017. 10.1093/молбев/msr282.
ПабМед
ПабМед Центральный
Статья
Google ученый
Chen J, Hu Q, Zhang Y, Lu C, Kuang H: P-MITE: база данных для миниатюрных мобильных элементов растений с инвертированным повторением. Нуклеиновые Кислоты Res. 2014, 42: Д1176-Д1181. 10.1093/нар/гкт1000.
ПабМед
ПабМед Центральный
Статья
Google ученый
Беннетцен Дж.Л., Коулман С. , Лю Р., Ма Дж., Рамакришна В.: Постоянная завышенная оценка числа генов в сложных геномах растений. Curr Opin Plant Biol. 2004, 7: 732-736. 10.1016/j.pbi.2004.09.003.
, Лю Р., Ма Дж., Рамакришна В.: Постоянная завышенная оценка числа генов в сложных геномах растений. Curr Opin Plant Biol. 2004, 7: 732-736. 10.1016/j.pbi.2004.09.003.
ПабМед
Статья
Google ученый
Лера Э. Идентификация повторов и мобильных элементов в секвенированных геномах: как найти дорогу в густом лесу программ. Наследственность. 2009, 104: 520-533. 10.1038/hdy.2009.165.
ПабМед
Статья
Google ученый
Шуле Ф., Уикер Т., Рустенхольц С., По Э., Сальс Дж., Лерой П., Шлуб С., Ле Паслье М.-С., Магделенат Г., Гонтье С.: Секвенирование на уровне мегабазы выявляет противоположные модели организации и эволюции гена пшеницы и мобильных пространства элементов. Растительная клетка. 2010, 22: 1686-1701. 10.1105/тпк.110.074187.
ПабМед
ПабМед Центральный
Статья
Google ученый
СанМигель П.Дж., Рамакришна В., Беннетцен Дж.Л., Буссо К.С., Дубковский Дж. Мобильные элементы, гены и рекомбинация в контиге размером 215 т.п.н. из хромосомы пшеницы 5Am. Функц Интегр Геномикс. 2002, 2: 70-80. 10.1007/s10142-002-0056-4.
ПабМед
Статья
Google ученый
Li W, Zhang P, Fellers JP, Friebe B, Gill BS: Состав последовательности, организация и эволюция основного генома Triticeae. Завод Дж. 2004, 40: 500-511. 10.1111/j.1365-313X.2004.02228.x.
ПабМед
Статья
Google ученый
Sabot F, Guyot R, Wicker T, Chantret N, Laubin B, Chalhoub B, Leroy P, Sourdille P, Bernard M: Обновление аннотаций мобильных элементов из больших геномных последовательностей пшеницы выявило разнообразную активность и ассоциации генов. Мол Генет Геномикс. 2005, 274: 119-130. 10.1007/s00438-005-0012-9.
ПабМед
Статья
Google ученый
Paux E, Roger D, Badaeva E, Gay G, Bernard M, Sourdille P, Feuillet C: Характеристика состава и эволюции гомеологических геномов гексаплоидной пшеницы посредством секвенирования BAC-конца на хромосоме 3B. Завод Дж. 2006, 48: 463-474. 10.1111/j.1365-313X.2006.02891.x.
ПабМед
Статья
Google ученый
Charles M, Belcram H, Just J, Huneau C, Viollet A, Couloux A, Segurens B, Carter M, Huteau V, Coriton O: Динамика и дифференциальная пролиферация мобильных элементов в ходе эволюции геномов B и A пшеницы. Генетика. 2008, 180: 1071-1086. 10.1534/генетика.108.0
.
ПабМед
ПабМед Центральный
Статья
Google ученый
TREP, база данных последовательностей Triticeae REPeat. [http://wheat.pw.usda.gov/ITMI/Repeats/]
Бренчли Р., Спаннагл М., Пфайфер М., Баркер Г.Л., Д’Амор Р. , Аллен А.М., Маккензи Н., Крамер М., Керхорну А. , Bolser D: Анализ генома мягкой пшеницы с использованием секвенирования всего генома. Природа. 2012, 491: 705-710. 10.1038/природа11650.
, Аллен А.М., Маккензи Н., Крамер М., Керхорну А. , Bolser D: Анализ генома мягкой пшеницы с использованием секвенирования всего генома. Природа. 2012, 491: 705-710. 10.1038/природа11650.
ПабМед
ПабМед Центральный
Статья
Google ученый
Ling HQ, Zhao S, Liu D, Wang J, Sun H, Zhang C, Fan H, Li D, Dong L, Tao Y, Gao C, Wu H, Li Y, Cui Y, Guo X, Zheng S, Wang B, Yu K, Liang Q, Yang W, Lou X, Chen J, Feng M, Jian J, Zhang X, Luo G, Jiang Y, Liu J, Wang Z, Sha Y и др.: Проект генома предшественник А-генома пшеницы Triticum urartu. Природа. 2013, 496: 87-90. 10.1038/природа11997.
ПабМед
Статья
Google ученый
Jia J, Zhao S, Kong X, Li Y, Zhao G, He W, Appels R, Pfeifer M, Tao Y, Zhang X, Jing R, Zhang C, Ma Y, Gao L, Gao C, Spannagl M, Mayer KF, Li D, Pan S, Zheng F, Hu Q, Xia X, Li J, Liang Q, Chen J, Wicker T, Gou C, Kuang H, He G, Luo Y и др. : Aegilops tauschii draft последовательность генома раскрывает репертуар генов для адаптации пшеницы. Природа. 2013, 496: 91-95. 10.1038/природа12028.
: Aegilops tauschii draft последовательность генома раскрывает репертуар генов для адаптации пшеницы. Природа. 2013, 496: 91-95. 10.1038/природа12028.
ПабМед
Статья
Google ученый
Международный консорциум по секвенированию генома пшеницы. [http://www.wheatgenome.org/]
Шуле Ф., Альберти А., Тейл С., Гловер Н., Барбе В., Дарон Дж., Пинго Л., Сурдиль П., Кулу А., По Э., Лерой П., Манжено С., Гийо Н., Ле Гуи Дж., Бальфурье Ф., Ало М., Жамилу В., Пулен Дж., Дюран С., Беллек А., Гаспин С., Сафар Дж., Долезель Дж., Роджерс Дж., Вандепуле К., Ори Дж. М., Майер К., Бержес Х. , Quesneville H, Wincker P и др.: Структурное и функциональное разделение хромосомы 3B мягкой пшеницы. Наука. 2014, 345: 1249721-10.1126/научн.1249721.
ПабМед
Статья
Google ученый
IWGSC: Хромосомный проект последовательности генома гексаплоидной мягкой пшеницы (Triticum aestivum). Science 2014, 345:1251788.,
Science 2014, 345:1251788.,
Эль Байдури М., Панауд О.: Сравнительная геномная палеонтология в царстве растений раскрывает динамику эволюции генома, управляемой ТЕ. Геном Биол Эвол. 2013, 5: 954-965. 10.1093/gbe/evt025.
ПабМед
ПабМед Центральный
Статья
Google ученый
Flutre T, Duprat E, Feuillet C, Quesneville H: Рассмотрение диверсификации мобильных элементов в подходах к аннотации de novo. ПЛОС Один. 2011, 6: e16526-10.1371/journal.pone.0016526.
ПабМед
ПабМед Центральный
Статья
Google ученый
Vogel JP, Garvin DF, Mockler TC, Schmutz J, Rokhsar D, Bevan MW, Barry K, Lucas S, Harmon-Smith M, Lail K: секвенирование генома и анализ модельной травы Brachypodium distachyon. Природа. 2010, 463: 763-768. 10.1038/природа08747.
Артикул
Google ученый
Baucom RS, Estill JC, Chaparro C, Upshaw N, Jogi A, Deragon J-M, Westerman RP, SanMiguel PJ, Bennetzen JL: исключительное разнообразие, неслучайное распределение и быстрая эволюция ретроэлементов в геноме кукурузы B73. Генетика PLoS. 2009, 5: e1000732-10.1371/journal.pgen.1000732.
ПабМед
ПабМед Центральный
Статья
Google ученый
Rustenholz C, Choulet F, Laugier C, Šafář J, Šimková H, Doležel J, Magni F, Scalabrin S, Cattonaro F, Vautrin S: карта транскрипции хромосомы 3B из 3000 локусов раскрывает структурные и функциональные особенности гена островков у гексаплоидной пшеницы. Завод Физиол. 2011, 157: 1596-1608. 10.1104/стр.111.183921.
ПабМед
ПабМед Центральный
Статья
Google ученый
Wicker T, Guyot R, Yahiaoui N, Keller B: Транспозоны CACTA в Triticeae. Разнообразное семейство часто повторяющихся элементов. Завод Физиол. 2003, 132: 52-63. 10.1104/стр.102.015743.
Завод Физиол. 2003, 132: 52-63. 10.1104/стр.102.015743.
ПабМед
ПабМед Центральный
Статья
Google ученый
Лю Р., Витте С., Ма Дж., Махама А.А., Дхливайо Т., Ли М., Беннетцен Дж.Л.: Анализ генома кукурузы с помощью GeneTrek. Proc Natl Acad Sci U S A. 2007, 104: 11844-11849. 10.1073/пнас.0704258104.
ПабМед
ПабМед Центральный
Статья
Google ученый
Рис Х., Уолтерс М.: Ядерная ДНК и эволюция пшеницы. Наследственность. 1965, 20: 73-82. 10.1038/hdy.1965.9.
Артикул
Google ученый
Кашкуш К., Фельдман М., Леви А.А. Транскрипционная активация ретротранспозонов изменяет экспрессию соседних генов у пшеницы. Нат Жене. 2002, 33: 102-106. 10.1038/нг1063.
ПабМед
Статья
Google ученый
Parisod C, Alix K, Just J, Petit M, Sarilar V, Mhiri C, Ainouche M, Chalhoub B, Grandbastien MA: Влияние мобильных элементов на организацию и функцию аллополиплоидных геномов. Новый Фитол. 2010, 186: 37-45. 10.1111/j.1469-8137.2009.03096.х.
ПабМед
Статья
Google ученый
Wright SI, Agrawal N, Bureau TE: Влияние скорости рекомбинации и плотности генов на распределение мобильных элементов в Arabidopsis thaliana. Геном Res. 2003, 13: 1897-1903.
ПабМед
ПабМед Центральный
Google ученый
Yang G, Lee YH, Jiang Y, Shi X, Kertbundit S, Hall TC: Двусторонняя роль мобильного элемента Kiddo в промоторе убиквитина2 риса. Растительная клетка. 2005, 17:1559-1568. 10.1105/тпк.104.030528.
ПабМед
ПабМед Центральный
Статья
Google ученый
Han Y, Qin S, Wessler SR: Сравнение мобильных элементов класса 2 при разрешении надсемейства выявляет консервативные и отличные черты в геномах злаковых трав. Геномика BMC. 2013, 14: 71-10.1186/1471-2164-14-71.
ПабМед
ПабМед Центральный
Статья
Google ученый
Kuang H, Padmanabhan C, Li F, Kamei A, Bhaskar PB, Ouyang S, Jiang J, Buell CR, Baker B: Идентификация миниатюрных мобильных элементов с инвертированным повтором (MITE) и биогенез их siРНК у пасленовых: новые функциональные последствия для MITE. Геном Res. 2009, 19: 42-56. 10.1101/гр.078196.108.
ПабМед
ПабМед Центральный
Статья
Google ученый
Консорциум IBGS: Сборка физической, генетической и функциональной последовательности генома ячменя. Природа. 2012, 491: 711-716.
Google ученый
Batzer MA, Deininger PL: повторы Alu и геномное разнообразие человека. Нат Рев Жене. 2002, 3: 370-379. 10.1038/nrg798.
ПабМед
Статья
Google ученый
Хокинс Дж.С., Ким Х., Насон Дж.Д., Винг Р.А., Вендел Дж.Ф.: Дифференциальная родословная амплификация мобильных элементов ответственна за изменение размера генома у Gossypium. Геном Res. 2006, 16: 1252-1261. 10.1101/гр.5282906.
ПабМед
ПабМед Центральный
Статья
Google ученый
Piegu B, Guyot R, Picault N, Roulin A, Saniyal A, Kim H, Collura K, Brar DS, Jackson S, Wing RA: Удвоение размера генома без полиплоидизации: динамика геномной экспансии, вызванной ретротранспозицией, у Oryza australiensis , дикий родственник риса. Геном Res. 2006, 16: 1262-1269. 10.1101/гр.52
.
ПабМед
ПабМед Центральный
Статья
Google ученый
Vitte C, Panaud O: Ретротранспозоны LTR и размер генома цветковых растений: появление модели увеличения/уменьшения. Цитогенет Геном Res. 2005, 110: 91-107. 10.1159/000084941.
ПабМед
Статья
Google ученый
Hawkins JS, Proulx SR, Rapp RA, Wendel JF: Быстрая потеря ДНК как противовес расширению генома за счет пролиферации ретротранспозонов в растениях. Proc Natl Acad Sci U S A. 2009, 106: 17811-17816. 10.1073/пнас.0
ПабМед
ПабМед Центральный
Статья
Google ученый
Забала Г., Водкин Л.О.: Мутация wp гена Glycine max несет богатый фрагментами гена транспозон надсемейства CACTA. Растительная клетка. 2005, 17: 2619-2632. 10.1105/тпк.105.033506.
ПабМед
ПабМед Центральный
Статья
Google ученый
Takahashi S, Inagaki Y, Satoh H, Hoshino A, Iida S: Захват последовательности геномного домена HMG мобильным элементом Tpn1, связанным с En/Spm, в японской ипомеи. Мол Ген Жене. 1999, 261: 447-451. 10.1007/s004380050987.
Мол Ген Жене. 1999, 261: 447-451. 10.1007/s004380050987.
ПабМед
Статья
Google ученый
Wicker T, Buchmann JP, Keller B: Исправление пробелов в геномах растений приводит к перемещению генов и эрозии колинеарности. Геном Res. 2010, 20: 1229-1237. 10.1101/гр.107284.110.
ПабМед
ПабМед Центральный
Статья
Google ученый
Jiang N, Bao Z, Zhang X, Eddy SR, Wessler SR: Мобильные элементы Pack-MULE опосредуют генную эволюцию растений. Природа. 2004, 431: 569-573. 10.1038/природа02953.
ПабМед
Статья
Google ученый
Altschul SF, Madden TL, Schaffer AA, Zhang J, Zhang Z, Miller W, Lipman DJ: Gapped BLAST и PSI-BLAST: новое поколение программ поиска белковых баз данных. Нуклеиновые Кислоты Res. 1997, 25: 3389-3402. 10.1093/нар/25. 17.3389.
17.3389.
ПабМед
ПабМед Центральный
Статья
Google ученый
Enright AJ, Van Dongen S, Ouzounis CA: Эффективный алгоритм для крупномасштабного обнаружения белковых семейств. Нуклеиновые Кислоты Res. 2002, 30: 1575-1584. 10.1093/нар/30.7.1575.
ПабМед
ПабМед Центральный
Статья
Google ученый
Katoh K, Kuma K-i, Toh H, Miyata T: MAFFT версии 5: повышение точности множественного выравнивания последовательностей. Нуклеиновые Кислоты Res. 2005, 33: 511-518. 10.1093/нар/гки198.
ПабМед
ПабМед Центральный
Статья
Google ученый
Уотерхаус А.М., Проктер Дж.Б., Мартин Д.М., Клэмп М., Бартон Г.Дж.: Jalview Version 2 — редактор множественного выравнивания последовательностей и инструментальные средства анализа. Биоинформатика. 2009, 25: 1189-1191. 10.1093/биоинформатика/btp033.
2009, 25: 1189-1191. 10.1093/биоинформатика/btp033.
ПабМед
ПабМед Центральный
Статья
Google ученый
Смит АФА, Хабли Р., Грин П: RepeatMasker Open-3.0. [http://www.repeatmasker.org/]
Стаджич Дж. Э., Блок Д., Булез К., Бреннер С. Е., Червиц С. А., Дагдигиан С., Фюлен Г., Гилберт Дж. Г., Корф И., Лапп Х. Инструментарий Bioperl: Модули Perl для наук о жизни. Геном Res. 2002, 12: 1611-1618. 10.1101/гр.361602.
ПабМед
ПабМед Центральный
Статья
Google ученый
Дарон Дж.: CLARI-TE. [https://github.com/jdaron/CLARI-TE]
Edgar RC: MUSCLE: множественное выравнивание последовательностей с высокой точностью и высокой пропускной способностью. Нуклеиновые Кислоты Res. 2004, 32: 1792-1797. 10.1093/нар/гх440.
ПабМед
ПабМед Центральный
Статья
Google ученый
СанМигель П., Гаут Б.С., Тихонов А., Накадзима Ю., Беннетцен Д.Л.: Палеонтология межгенных ретротранспозонов кукурузы. Нат Жене. 1998, 20: 43-45. 10.1038/1695.
ПабМед
Статья
Google ученый
Прайс М.Н., Дехал П.С., Аркин А.П.: FastTree 2 – приблизительно деревья максимального правдоподобия для больших выравниваний. ПЛОС Один. 2010, 5: e9490-10.1371/journal.pone.0009490.
ПабМед
ПабМед Центральный
Статья
Google ученый
Рамбо А: FigTree-v1.4.2. [http://tree.bio.ed.ac.uk/software/figtree/]
Suzuki R, Shimodaira H: Pvclust: пакет R для оценки неопределенности в иерархической кластеризации. Биоинформатика. 2006, 22: 1540-1542. 10.1093/биоинформатика/btl117.
ПабМед
Статья
Google ученый
Скачать ссылки
Благодарности
Этот проект был поддержан грантами Французского национального исследовательского агентства (ANR-09-GENM-025 3BSEQ), грант от France Agrimer и грант (проект DL-BLE) от подразделения INRA BAP. JD финансируется за счет гранта Министерства исследований Франции. NG финансируется за счет гранта Европейской комиссии по исследовательской учебной программе Marie-Curie Actions (FP7-MC-IIF-NoncollinearGenes). LP финансируется за счет гранта региона Овернь.
JD финансируется за счет гранта Министерства исследований Франции. NG финансируется за счет гранта Европейской комиссии по исследовательской учебной программе Marie-Curie Actions (FP7-MC-IIF-NoncollinearGenes). LP финансируется за счет гранта региона Овернь.
Информация об авторе
Авторы и организации
INRA UMR1095 Генетика, разнообразие и экофизиология зерновых, 5 chemin de Beaulieu, Clermont-Ferrand, 63039, Франция
Жоскэн Дарон, Наташа Гловер, Лиз Пинго, Себастьен Тейл, Этьен По, Катрин Фейе и Фредерик Шуле
Университет Блеза Паскаля UMR1095 Генетика, разнообразие и экофизиология зерновых культур, Клермон-39-Фермон-де-0-де-Фермон-де-39 и Belieuchemin, 5 , Франция
Жоскэн Дарон, Наташа Гловер, Лиз Пинго, Себастьян Тейль, Этьен По, Катрин Фейе и Фредерик Шуле
INRA-URGI, Centre de Versailles, Route de Saint Cyr, Versailles, 79026, Франция0005
Véronique Jamilloux & Hadi Quesneville
CEA/DSV/IG/Genoscope, 2 rue Gaston Cremieux, Evry,
, France
Valérie Barbe, Sophie Mangenot, Adriana Alberti & Patrick Wincker
CNRS UMR 8030, 2 Rue Gaston Cremieux, Evry,
, France
Патрик Уинкер
Université D’Evry, Evry, P5706, France
Патрик Винкер
Автор
9
. 0004 Посмотреть публикации автора
0004 Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Академия
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar
Автор, ответственный за переписку
Фредерик Шуле.
Дополнительная информация
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Вклад авторов
JD выполнил программирование, провел анализ данных и написал статью. Компания NG провела обнаружение несинтеновых генов. LP собрала и проанализировала данные экспрессии RNAseq и провела кластерный анализ. ST произвел аннотацию генов и сборку генома. VJ участвовал в процессе аннотации TE. EP и HQ участвовали в разработке исследования и критическом пересмотре рукописи. VB, SM, AA и PW участвовали в создании последовательности хромосомы 3B. CF участвовал в разработке проекта, интерпретации данных, координации проекта и критическом пересмотре рукописи. FC разработал исследование, руководил этой работой, участвовал в анализе данных и завершил работу над документом. Все авторы прочитали и одобрили окончательный вариант рукописи.
Электронный дополнительный материал
13059_2014_546_MOESM1_ESM.pptx
Дополнительный файл 1: Следующие дополнительные данные доступны с онлайн-версией этого документа. Таблица S1. TE состав (в процентах от последовательности) хромосомы 3B мягкой пшеницы и проектных геномных последовательностей Triticum urartu и Aegilops tauschii . Таблица S2. Корреляция между содержанием ТЭ, скоростью генетической рекомбинации и плотностью генов. Рисунок S1. Распределение среднего процента сходства между семействами LTR-RT для Brachypodium (bd), риса (os), сорго (sb), кукурузы (zm) и пшеницы (ta). Рисунок S2. Дендрограммы двух семейств LTR-RT: RLG_famc1 (A,B) и RLC_famc2 (C,D) . Рисунок S3. Распределение количества различных семейств TE, обнаруженных в окне размером 10 Мб, скользящем вдоль хромосомы 3B пшеницы (в Мб). Рисунок S4. Пропорции одиночных LTR, укороченных TE и скорости рекомбинации в трех разных областях хромосомы 3B. Рисунок S5. Преимущественное расположение цыганских семей по хромосоме 3В. (PPTX 3 МБ)
Таблица S1. TE состав (в процентах от последовательности) хромосомы 3B мягкой пшеницы и проектных геномных последовательностей Triticum urartu и Aegilops tauschii . Таблица S2. Корреляция между содержанием ТЭ, скоростью генетической рекомбинации и плотностью генов. Рисунок S1. Распределение среднего процента сходства между семействами LTR-RT для Brachypodium (bd), риса (os), сорго (sb), кукурузы (zm) и пшеницы (ta). Рисунок S2. Дендрограммы двух семейств LTR-RT: RLG_famc1 (A,B) и RLC_famc2 (C,D) . Рисунок S3. Распределение количества различных семейств TE, обнаруженных в окне размером 10 Мб, скользящем вдоль хромосомы 3B пшеницы (в Мб). Рисунок S4. Пропорции одиночных LTR, укороченных TE и скорости рекомбинации в трех разных областях хромосомы 3B. Рисунок S5. Преимущественное расположение цыганских семей по хромосоме 3В. (PPTX 3 МБ)
Оригинальные файлы изображений, представленные авторами
Ниже приведены ссылки на файлы изображений, предоставленные авторами.
Авторский файл для рисунка 1
Авторский файл для рисунка 2
Авторский файл для рисунка 3
5 Авторский файл для рисунка 3
Оригинальный файл авторов для рисунка 5
Оригинальный файл авторов для рисунка 6
Права и разрешения
Перепечатки и разрешения
Об этой статье
Все о компенсации GST Cementsation Cemence & Resects
444. Сессия взимается в соответствии с Законом о налоге на товары и услуги (компенсация штатам) 2017 года. Целью взимания этой суммы является компенсация штатам потери дохода, возникающей из-за введения GST 1 июля 2017 года в течение пяти лет. или такой период, как рекомендовано Советом GST.
GST, будучи налогом, основанным на потреблении, приведет к потере доходов для штатов с тяжелым производством.
Кто должен собирать компенсацию GST?
Все налогоплательщики, занимающиеся поставкой отдельных товаров или услуг, кроме экспортеров и составных налогоплательщиков, будут получать компенсацию. Это также будет включать компенсацию, взимаемую с определенных товаров, импортируемых в Индию. В случае, если компенсация выплачивается за экспорт, экспортер может потребовать ее возмещения.
Это также будет включать компенсацию, взимаемую с определенных товаров, импортируемых в Индию. В случае, если компенсация выплачивается за экспорт, экспортер может потребовать ее возмещения.
На какие товары распространяется действие компенсации?
Различные товары и их соответствующие ставки налога предусмотрены Законом о налоге на товары и услуги (компенсации штатам) от 2017 года, в который время от времени вносятся поправки, и они перечислены ниже:
| Товары | |||
| Нарезанный табак | 20% | ||
| Табак необработанный (с известковой трубкой) – с торговой маркой | 65% | ||
| Unmanufactured tobacco (without lime tube) – with a brand name | 71% | ||
| Branded tobacco refuse | 61% | ||
| Tobacco extracts and essence bearing a brand name | 72% | ||
| Табачные экстракты и эссенции, не имеющие торговой марки | 65% | ||
| Фильтр-кхайни | 160% | ||
| Ароматизированный табак Jarda | |||
| Черуты и сигары | 21% или 4170 за тысячу, в зависимости от того, что выше | ||
| Сигариллы | 21% или рупий. 4170 за тысячу, в зависимости от того, что больше 4170 за тысячу, в зависимости от того, что больше | ||
| Сигареты, содержащие табак, кроме сигарет с фильтром, длиной не более 65 мм | 5% + 2076 за тысячу | ||
| Сигареты, содержащие табак, кроме сигарет с фильтром, длиной более 65 мм и до 75мм | 5% + 3668 за тысячу | ||
| Сигареты с фильтром длиной (включая длину фильтра, длина фильтра составляет 11 миллиметров или его фактическая длина, в зависимости от того, что больше) не более 65 миллиметров | 5% + 2076 рупий за тыс. | Сигареты с фильтром длиной (включая длину фильтра, при этом длина фильтра составляет 11 миллиметров или его фактическая длина, в зависимости от того, что больше) более 65 миллиметров, но не более 70 миллиметров | 5% + 2747 рупий за тысяч |
| Сигареты с фильтром, длина которых (включая длину фильтра, длина фильтра составляет 11 миллиметров или его фактическая длина, в зависимости от того, что больше) превышает 70 миллиметров, но не превышает 75 миллиметров | 5% + 3668 рупий за тысяч | ||
| Сигареты из заменителей табака | 4006 рупий за тысячу | ||
| Сигариллы из заменителей табака | 1 9015% 4006 за тысячу, в зависимости от того, что равно Выше | ||
| курительные смеси для труб и сигарет | 290% | ||
| Бренд «Кальян» или «Гудаку» | 72% | 17% | |
| Прочий курительный табак для кальяна, не имеющий торговой марки | 11% | ||
| Прочий курительный табак | 49% | ||
| Other smoking tobacco not bearing a brand name | 11% | ||
| Homogenised or reconstituted tobacco, bearing a brand name | 72% | ||
| Chewing tobacco (without lime tube) | 160% | ||
| Табак жевательный (с известковой трубкой) | 142% | ||
| Препараты, содержащие жевательный табак | 72% | ||
| Пан масала0153 | 204% | ||
| Все товары, кроме пан масала , содержащие табак «гутха», имеющие торговую марку name | 89% | ||
| Snuff | 72% | ||
| Preparations containing snuff | 72% | ||
| Coal, ovoids, briquettes, and similar solid fuels manufactured from lignite, coal, whether or not agglomerated, кроме стружки, торфа (включая торфяную подстилку), агломерированного или неагломерированного | Rs. 400 per tonne 400 per tonne | ||
| Aerated waters | 12% | ||
| Lemonade | 12% | ||
| Others | 12% | ||
| Motorcycles of engine capacity exceeding 350 cc | 3% | ||
| Самолеты (включая вертолеты и т.п.) для личного пользования | 3 % | ||
| Яхты и другие плавучие средства для отдыха или спорта | 3 % | ||
| 15% | |||
Автомобили, за исключением машин скорой помощи, трехколесных транспортных средств и транспортных средств с объемом двигателя не более 1500 см3 и длиной не более 4000 мм, с поршневым двигателем внутреннего сгорания с искровым зажиганием и электродвигателем в качестве двигателей для движения или с поршневым двигателем внутреннего сгорания с воспламенением от сжатия [дизелем или полудизелем] и электродвигателем в качестве силовых двигателей транспортные средства с объемом двигателя не более 1200 см3 и длиной не более 4000 мм. | 1% | ||
| Автомобили с дизельным двигателем, объемом двигателя не более 1500 см3 и длиной не более 4000 мм. | 3% | ||
| Автомобили с объемом двигателя не более 1500 куб. см | 17% | ||
| Автомобили с объемом двигателя более 1500 куб. | |||
| Автомобили с объемом двигателя более 1500 см3, широко известные как внедорожники (SUV), включая внедорожники. | 22% |
Как использовать входной налоговый кредит (ITC) на компенсацию?
Предварительный налоговый вычет по компенсационному цессию может быть использован только для зачета обязательства по компенсационному цессию, возникающего из-за внешней поставки.
Как рассчитать компенсацию?
Компенсация взимается сверх суммы налога на товары и услуги, взимаемой в отношении конкретной поставки. Расчет аналогичен налогу на товары и услуги: установленная ставка применяется к стоимости сделки, указанной в разделе 15 Закона о налоге на товары и услуги 2017 года, чтобы получить обязательство по цессии.
Как компенсация будет распределяться между штатами?
Сумма компенсации, подлежащая распределению по каждому штату, рассчитывается следующим образом:
Шаг 1: Базовый доход = Налоговый доход штата в 2016–2017 финансовом году.
Шаг 2: Предположим, темпы роста равны 14%, и рассчитаем прогнозируемый доход на каждый финансовый год.
Значение прогнозируемого дохода состоит в том, что это был бы доход, который штат мог бы получить, если бы налог на товары и услуги не был введен. Этот расчет делается для периода в пять лет, поскольку предполагается, что компенсация будет действовать в течение пятилетнего переходного периода.
Шаг 3: Рассчитайте компенсацию, подлежащую уплате за каждый финансовый цвет,
| Проектированный доход для этого конкретного финансового года | xxx | |
| xxx | ||
| xxx | ||
 Увеличение ресурса — защитный слой значительно снижает интенсивность изнашивания наиболее нагруженных деталей трения, которые определяют ресурс двигателя.
Увеличение ресурса — защитный слой значительно снижает интенсивность изнашивания наиболее нагруженных деталей трения, которые определяют ресурс двигателя. На каждом этапе необходимо добавить состав в моторное масло согласно следующей процедуре.
На каждом этапе необходимо добавить состав в моторное масло согласно следующей процедуре. Если масло стало плотно чёрным, необходимо произвести его досрочную замену и перейти ко второму этапу.
Если масло стало плотно чёрным, необходимо произвести его досрочную замену и перейти ко второму этапу.
 56.8(h) с разрешенной производителем полной массой транспортного средства от 8 501 до 14 000 фунтов.
56.8(h) с разрешенной производителем полной массой транспортного средства от 8 501 до 14 000 фунтов. 21 по 8703.90, 8704.21 и 8704.31;
21 по 8703.90, 8704.21 и 8704.31;

